מחקר חדש חושף כי מנגנוני מוח מתקדמים, שנחשבו לייחודיים ליונקים, היו קיימים בצבים כבר לפני מאות מיליוני שנים


מחקר
מחקר חדש חושף כי מנגנוני מוח מתקדמים, שנחשבו לייחודיים ליונקים, היו קיימים בצבים כבר לפני מאות מיליוני שנים

הצב נחשב לחיה פרה-היסטורית ומסתורית, שמזכירה לנו את תקופת הדינוזאורים. לרוב אנחנו מזכירים אותו בהקשר של שיריונו הקשיח והמרשים או איטיות תנועתו, אבל מסתבר שהצב נותן לנו שיעור חשוב בהיסטוריה: מחקר חדש של חוקרי אוניברסיטת תל אביב על המוח של הצבים שופך אור על התפתחויות אבולוציוניות לפני מאות מיליוני שנים ומציג ממצא מפתיע על דרך פעולתו של המוח הקדום: קליפת המוח החזותית של צבים מסוגלת לזהות גירויים חזותיים בלתי צפויים באופן שאינו תלוי במיקום שלהם על הרשתית. מדובר בתכונה שעד כה יוחסה רק לקליפות מוח מפותחות של יונקים, כולל בני אדם. בעקבות הממצאים צוות החוקרים מעריך מנגנונים מוחיים מתקדמים, שנחשבו עד כה לייחודיים ליונקים ולבני אדם, היו קיימים כבר לפני מאות מיליוני שנים.
המחקר נערך בהובלת מילאן בקר, נמרוד לברשטיין וד"ר מארק שיין־אידלסון, חוקרים במחלקה לנוירוביולוגיה בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז, ובבית ספר סגול למדעי המוח באוניברסיטת תל אביב. המחקר פורסם בכתב העת היוקרתי Science Advances.
אוכלוסיית הצבים והיונקים התפצלו מאב קדמון משותף לפני כ־320 מיליון שנה. מאז, מוח היונקים, וקליפתו בפרט, עברה התפתחויות דרמטיות והפכה למורכבת, גדולה ומקופלת. מוח הצב לעומת זאת, נחשב פשוט יותר ודומה יותר לזה של האב הקדמון של הזוחלים והיונקים. לכן, כאשר מתגלה במוח של צב מנגנון חישובי מתוחכם, ההשערה היא שהוא היה קיים כבר במוחם של בעלי החיים הקדומים הראשונים שעלו ליבשה.
במסגרת המחקר, החוקרים התמקדו בקליפת המוח הדורסלית של הצב - אזור שנחשב הומולוג אבולוציוני (בעל שוויון מבני, מקור התפתחותי משותף או דמיון גנטי), לקליפת המוח של יונקים. באמצעות הקלטות עצביות מצבים ערניים, ומעקב אחר תנועות עיניים, החוקרים בדקו כיצד מגיב מוח הצב לגירויים חזותיים החוזרים על עצמם לעומת גירויים "חריגים" המופיעים במיקום בלתי צפוי בשדה הראייה. התוצאות היו מפתיעות.
"החלק המפתיע באמת הגיע כאשר בדקנו מה קורה בזמן שהצב מזיז את ראשו או את עיניו", אומר ד"ר שיין-אידלסון." שינוי כזה מזיז את התמונה על הרשתית ועלול ליצור 'בלבול' במערכת הראייה. אך אצל הצבים התגובה לגירוי החריג והרגיל נשארה עקבית, למרות השינויים התכופים בזווית המבט. במילים פשוטות: המוח של הצב 'מבין' שמשהו חדש קרה בסביבה, גם אם הצב רואה את התמונה מזווית אחרת כך שהיא לא נופלת בדיוק על אותו מקום בעין".
עוד נמצא כי תנועות עצמיות של הצב, כמו הזזת הראש או העיניים, כמעט שאינן מעוררות תגובה מוחית משמעותית, למרות שהן משנות מאוד את התמונה שנקלטת בעין. לעומת זאת, שינוי קטן אך לא צפוי בסביבה החיצונית מפעיל את המוח בצורה חזקה. הדבר מעיד על יכולת להבדיל בין גירויים שנובעים מתנועה עצמית לבין מידע חדש שדורש תשומת לב.

צוות המחקר (מימין לשמאל): ד"ר מארק שיין־אידלסון, נמרוד לברשטיין ומילאן בקר
לדברי החוקרים, הממצאים משנים את האופן שבו אנו מבינים את התפתחות המוח. עד היום סברו שמנגנונים מתקדמים כאלה התפתחו רק בשלבים מאוחרים של האבולוציה אצל יונים, ומופיעים במוחות מורכבים כמו של קופים ובני אדם. המחקר החדש מציע תמונה שונה: כבר במוחות קדומים מאוד, כמו זה של האבות הקדמונים של הצב, הייתה קיימת יכולת לזהות אירועים חשובים בסביבה.
היכולת הזו, כך מעריכים החוקרים, שימשה את בעלי החיים להבנה של הסביבה המרחבית שלהם, ללמידה ולהישרדות בעולם משתנה. מתברר שגם בלי קליפת מוח גדולה ומקופלת, לצבים יש מערכת חכמה שיודעת להבחין מתי משהו באמת חשוב קורה סביבם.
"המחקר מדגים כיצד מוחם של צבים משמש כחלון ייחודי אל העבר האבולוציוני. מאחר שצבים ויונקים התפצלו מאב קדמון משותף לפני מאות מיליוני שנים, גילוי מנגנונים מוחיים מתקדמים אצל צבים מעיד כי יכולות אלו היו קיימות כבר במוחות הקדומים ביותר. הממצאים מצביעים על כך שהיכולת לזהות התרחשויות חדשות וחשובות בסביבה, בלי להיות מושפעים מתנועות ראש ועניים עצמיות, היא אחת מאבני היסוד שעליהן נבנתה ההתפתחות של המוח שלנו", מסכם ד"ר שיין-אידלסון.

על מה הוא חושב שם מתחת לשיריון? צב יבשה מצוי
ד"ר מארק שיין־אידלסון הוא חוקר בכיר בבית הספר לנוירוביולוגיה, ביוכימיה וביופיזיקה ובבית ספר סגול למדעי המוח באוניברסיטת תל אביב. הוא בעל תארים מתקדמים בפיזיקה ובהנדסת חשמל וזוכה מענק ה-ERC. ד"ר שיין-אידלסון מתמקד במחקרו באבולוציה של חישוב עצבי ועיבוד חושי באמצעות מודלים של זוחלים, מתוך מטרה לפענח את עקרונות היסוד החישוביים המשותפים לרשתות עצביות ביולוגיות.

מחקר
מטרת החוקרים הייתה להשפיע על האופן שבו הזיכרון מתקבע מחדש במוח, ובכך להקל על הסימפטומים של הפוסט-טראומה

פוסט־טראומה משפיעה על מיליוני אנשים בעולם – חיילים, נפגעי טרור, תאונות דרכים ואלימות. על אף התקדמות בטיפולים פסיכולוגיים ותרופתיים, רק כ־50% מהמטופלים מגיבים היטב לטיפולים הקיימים, וזיכרונות חודרניים ממשיכים ללוות רבים מהם שנים לאחר האירוע. הזיכרונות הללו אינם "רק" מחשבות – הם חוויה חיה, מוחשית, שמפעילה מחדש את הגוף והרגש כאילו האירוע הקשה מתרחש שוב.
מחקר חדש שנערך באוניברסיטת תל אביב מציג גישה חדשנית לטיפול בפוסט־טראומה (PTSD) ומעורר עניין רב במיוחד על רקע העלייה החדה במספר המתמודדים עם התסמונת בעקבות מלחמת חרבות ברזל ואירועי 7 באוקטובר. לפי ממצאים ראשוניים של המחקר, טיפול באמצעות גירוי מוחי לא פולשני הצליח להפחית באופן משמעותי זיכרונות חודרניים, כמו פלאשבקים ומחשבות פולשניות, הנחשבים לאחד הסימפטומים הקשים והעמידים ביותר לטיפול.
המחקר נערך במעבדה של פרופ' ניצן צנזור מבית הספר סגול למדעי המוח ובית הספר למדעי הפסיכולוגיה באוניברסיטת תל אביב, בהובלת הדוקטורנט אור דזציו ובשיתוף פעולה עם המעבדות של פרופ' יאיר בר־חיים ופרופ' עידו תבור. צוות המחקר כלל את נוגה יאיר, נוגה מנדלוביץ', ד"ר ניב טיק, את ד"ר חגי שרון מביה"ח איכילוב, ואת פרופ' דניאל פיין מהמכון הלאומי לבריאות הנפש (NIMH) בארה״ב. המחקר פורסם בכתב העת המדעי Brain Stimulation.
החוקרים התמקדו בהיפוקמפוס – אזור עמוק במוח שאחראי על עיבוד, אחסון ושליפה של זיכרונות. מאחר שגירוי ישיר של אזורים עמוקים במוח מחייב התערבות פולשנית, נעשה שימוש בשיטה עקיפה ומתוחכמת: זיהוי אזורים שטחיים במוח שמחוברים תפקודית להיפוקמפוס, וגירוי שלהם באמצעות גירוי מגנטי מוחי (TMS). מיקום הגירוי נקבע באופן אישי לכל משתתף באמצעות סריקות ,fMRI מה שהפך את הטיפול למותאם אישית.
במחקר הראשוני השתתפו עשרה מבוגרים עם PTSD שעברו חמישה טיפולים שבועיים. בכל מפגש הופעל תחילה הזיכרון הטראומטי, ולאחר מכן ניתן הגירוי המוחי – בדיוק בשלב שבו הזיכרון נמצא במצב "גמיש" ופתוח לשינוי, במסגרת תהליך המכונה רה־קונסולידציה. מטרת החוקרים הייתה להשפיע על האופן שבו הזיכרון מתקבע מחדש במוח, ובכך להקל על הסימפטומים של הפוסט-טראומה.
התוצאות הראו ירידה חדה בחומרת תסמיני הפוסט־טראומה, ובעיקר בתדירות ובעוצמה של הזיכרונות החודרניים. כל המשתתפים הראו שיפור עקבי. במקביל, הדמיות מוח הראו ירידה בקישוריות בין ההיפוקמפוס לאזורי הגירוי – עדות לכך שהשינוי אינו רק סובייקטיבי, אלא משקף שינוי ממשי בפעילות המוח.
לממצאים חשיבות מיוחדת עבור חיילי צה״ל, אנשי כוחות הביטחון, אזרחים שנחשפו לאירועי הטרור ב־7 באוקטובר, שורדי הטבח ונפגעי הירי והחטיפות – אוכלוסיות שבהן שיעור הפוסט־טראומה צפוי להיות גבוה במיוחד. רבים מהם מדווחים על זיכרונות חודרניים עזים, גם חודשים לאחר האירועים. האפשרות לפתח טיפול קצר, לא פולשני, שמכוון ישירות למנגנון הזיכרון הטראומטי – עשויה להפוך לכלי משמעותי במערך השיקום הלאומי.
לדברי החוקרים, מדובר במחקר ראשוני בקבוצה קטנה וללא קבוצת ביקורת, אך כזה שמציג הוכחת היתכנות ברורה. כעת נדרשים ניסויים קליניים רחבים ומבוקרים כדי לבחון את יעילות השיטה לאורך זמן. אם הממצאים יאוששו, ייתכן שמדובר בשינוי כיוון מהותי באופן שבו מטפלים בזיכרון טראומטי – לא רק בהשלכות הרגשיות שלו, אלא בשורש העצבּי עצמו.
פרופ' ניצן צנזור מסכם: "הממצאים הראשוניים מצביעים על שינוי תפיסתי באופן שבו ניתן לגשת לטיפול בפוסט־טראומה. אנחנו מנסים כאן להתערב באופן ממוקד במנגנון המוחי של הזיכרון עצמו – בזמן שבו הוא 'נפתח' מחדש וניתן לשינוי. העובדה שראינו ירידה עקבית בזיכרונות החודרניים אצל כל המשתתפים, לצד שינוי מדיד בפעילות המוח, היא מעודדת מאוד. חשוב לי להדגיש שמדובר בתוצאות ראשוניות ביותר. יחד עם זאת, במיוחד על רקע המציאות הישראלית הנוכחית, אנחנו מקווים שהמשך המחקר הקליני המלא יאפשר בעתיד לפתח טיפול לא פולשני ונגיש, שיסייע לחיילים ולאזרחים רבים לחזור לחיים תפקודיים ללא פלישה מתמדת של הטראומה".

מחקר
צוות מחקר מאוניברסיטת תל אביב חשף מנגנון ביולוגי שמעודד ייצור מיאלין, ומציע תקווה לטיפולים חדשים במחלות נוירולוגיות כמו טרשת נפוצה ואלצהיימר

חוקרים וחוקרות מאוניברסיטת תל אביב חשפו מנגנון ביולוגי חדש אשר מגביר את ייצור המיאלין, חומר הבידוד שעוטף את שלוחות תאי העצב ותפקידו לסייע בהעברת האותות החשמליים בהם במהירות וביעילות. לדבריהם, ממצאי המחקר עשויים להוות בסיס לפיתוח טיפולים חדשניים להפרעות נוירולוגיות קשות בהן נפגע המיאלין, כגון טרשת נפוצה, אלצהיימר ותסמונות נוירו-התפתחותיות.
המחקר נערך במעבדתו של פרופ' בועז ברק מבית הספר סגול למדעי המוח ומבית הספר למדעי הפסיכולוגיה, בהובלתו של ד"ר גלעד לוי, ובשיתוף פעולה עם מעבדותיהם של ד"ר אסף מרקו מהאוניברסיטה העברית בירושלים, פרופ' אינה סלוצקי ופרופ' יניב אסף מאוניברסיטת תל אביב, פרופ' אליאור פלס ממכון ויצמן למדע ופרופ' הוקה ורנר מגרמניה. ממצאי המחקר פורסמו בכתב העת היוקרתי Nature Communications.
"פגיעה במיאלין מקושרת למגוון מחלות נוירו-דגנרטיביות כמו אלצהיימר וטרשת נפוצה (מחלה אוטו-אימונית שבה הגוף עצמו תוקף את המיאלין), וכן תסמונות נוירו-התפתחותיות כגון תסמונת ויליאמס ואוטיזם" מסביר פרופ' ברק. "במחקר הנוכחי התמקדנו בתאים האחראים על ייצור המיאלין במערכת העצבים המרכזית, אשר כוללת את המוח, ובמערכת העצבים ההיקפית. בתאים אלה חקרנו את התפקיד שממלא חלבון בשם TFII-I, הידוע ביכולתו להעלות או להוריד את רמת הביטוי של גנים שונים החשובים לתפקוד התאים. בעוד שידוע מזה שנים רבות שחלבון זה מעורב בשורה של מצבים פתולוגיים כגון בעיות בהתפתחות המוחית ותסמונות נוירו-התפתחותיות, עד כה לא היה ידוע אם וכיצד הוא פועל בהקשר של ייצור מיאלין במוח ובמערכות העצבים".
צוות המחקר גילה שהחלבון TFII-I פועל בגוף כמעין 'מעצור ביולוגי פנימי' שמעכב את תהליך ייצור המיאלין בתאים האחראים לכך. על בסיס תגלית זו הם שיערו שניתן יהיה להגביר את ייצור המיאלין על ידי הפחתת פעילותו של החלבון בתאים אלו. בכדי לבחון השערה זו השתמש הצוות בהנדסה גנטית מתקדמת בעכברי מודל: ביטוי החלבון בוטל באופן ממוקד רק בתאים מייצרי המיאלין, בעוד שבשאר התאים בגוף רמתו נותרה תקינה. לאחר מכן, הושוו העכברים שעברו את ההתערבות הגנטית לעכברים רגילים במגוון רחב של מדדים, ביניהם רמות החלבונים שמרכיבים את המיאלין, מבנה ועובי מעטפת המיאלין, מהירות ההולכה של האותות העצביים, ואף התנהגות העכברים.
"מצאנו שבהיעדר I-TFII התאים האחראים על ייצור המיאלין במוח הפיקו כמות גדולה יותר של חלבונים המרכיבים את המיאלין. כתוצאה מכך, המיאלין שנוצר היה עבה יותר ממיאלין רגיל, והשיפור המבני הזה הוביל לשיפור בתפקודו של המיאלין - כך שלשמחתנו עלתה מהירות ההולכה של המסר החשמלי בשלוחות תאי העצב. שיפורים אלה הובילו לשיפור ניכר ביכולות התנועתיות של העכברים, כמו קואורדינציה וכושר תנועה, ולשינויים התנהגותיים נוספים", מסביר ד"ר גלעד לוי.
פרופ' ברק מוסיף: "במחקר זה הצלחנו לראשונה להראות שאפשר 'לשחרר את הבלמים' על ייצור המיאלין במוח ובמערכת העצבים ההיקפית על ידי שליטה ברמת הביטוי של החלבון TFII-I. המחקר שלנו הוא בין הבודדים בעולם שגילו מנגנון להעלאת רמות המיאלין במוח. תוצאותיו עשויות לאפשר פיתוח של טיפולים עתידיים שידכאו את פעילות I-TFII בתאים האחראים על ייצור המיאלין ובכך יסייעו לשיקום המיאלין במגוון רחב של מחלות ניווניות והתפתחותיות בהן נפגע המיאלין - בהן אלצהיימר, טרשת נפוצה, תסמונת ויליאמס ואוטיזם. אנחנו מאמינים שלגישה חדשה זו, השונה מהותית מהטיפולים הקיימים כיום, יש פוטנציאל טיפולי נרחב".

מחקר
חוקרים באוניברסיטת תל אביב פיתחו שתל חוט שדרה אנושי שיאפשר למשותקים תנועה

צוות מחקר ישראלי בהובלת פרופ’ טל דביר ממרכז סגול לביוטכנולוגיה רגנרטיבית, ראש מרכז הננו-טכנולוגיה באוניברסיטת תל אביב והמדען הראשי של חברת הביוטק מטריסלף, הצליח לגדל לראשונה בעולם שתל של חוט שדרה אנושי במעבדה. השתל נועד להשתלב בחוט השדרה הפגוע של מטופלים משותקים, ולהחזיר להם את היכולת לנוע. מדובר באחת מפריצות הדרך החשובות ביותר ברפואה הרגנרטיבית, שיכולה לשנות את חייהם של מיליוני אנשים ברחבי העולם. כעת, לאחר שמשרד הבריאות אישר את התקדמות הניסוי לבני אדם, החוקרים אופטימיים מתמיד ולדבריהם יוכלו מטופלים לזכות ביכולת התנועה בתוך כשנה.
הניתוח המתוכנן להשתלת חוט שדרה אנושי מסמן שלב נוסף בתהליך שהחל לפני כשלוש שנים, כאשר במעבדתו של פרופ’ דביר באוניברסיטת תל אביב הצליחו לראשונה להנדס חוט שדרה אנושי תלת־ממדי מותאם אישית במעבדה. הממצאים פורצי הדרך פורסמו בכתב העת היוקרתי Advanced Science והראו כי עכברים שסבלו משיתוק כרוני והושתלו בהם השתלים המהונדסים החלו ללכת מחדש.
בעקבות ההצלחה, עברה הטכנולוגיה לפיתוח יישומי בחברת מטריסלף, שהוקמה בשנת 2019 על בסיס הטכנולוגיה המהפכנית להנדסת איברים שפותחה באוניברסיטת תל אביב על ידי פרופ’ דביר וצוותו, במסגרת הסכם רישוי עם רמות, חברת המסחור של האוניברסיטה. מנכ"ל החברה הוא גיל חכים, פרופ’ דביר ייסד את מטריסלף יחד עם ד"ר אלון סיני, והפיתוח המדעי מובל על ידי ד"ר תמר הראל־אדר וצוותה.
חוט השדרה בנוי מתאי עצב שמעבירים אותות חשמליים מהמוח לכל חלקי הגוף. ההחלטות מתקבלות במוח, האות החשמלי עובר דרכו לחוט השדרה, ומשם יוצאים נוירונים שמפעילים את השרירים. כאשר חוט השדרה נקרע בעקבות טראומה - תאונת דרכים, נפילה או פציעה צבאית - השרשרת הזאת נקטעת. אפשר לדמיין זאת כמו כבל חשמל שנחתך: כשהחלקים אינם מחוברים, האות לא עובר, והאדם מאבד את היכולת לשלוט בשריריו מעבר לפגיעה.
הבעיה הגדולה היא שחוט השדרה כמעט ואינו מסוגל להתחדש. הנוירונים אינם מתחלקים או מתחדשים כמו תאי עור; הם דומים יותר לתאי לב: ברגע שנגרם נזק, הגוף מתקשה לשקם אותו. לכן, הנזק שנגרם נשאר, ולעיתים מחמיר עד שהוא מתייצב ברמה משמעותית - מספיק כדי לגרום לשיתוק ממושך או קבוע.
השתל הייחודי מיוצר מתאי דם שנלקחים מהמטופל עצמו ומתוכנתים מחדש בהנדסה גנטית להיות תאי גזע, שהם תאים ייחודיים שמסוגלים להתפתח לסוגי רקמות שונים. התאים משתלבים בג’ל ביולוגי שמחקה את סביבת חוט השדרה בזמן ההתפתחות העוברית, וכך נוצרת "תשתית" טבעית שמסייעת לחידוש הקשרים העצביים.
לדברי החוקרים, הדגש על התאמה אישית חשוב במיוחד מאחר שמדובר בתאים של המטופל עצמו, וכך הסיכון לדחייה חיסונית קטן מאוד, מה שמגביר את סיכויי ההצלחה של השיקום. פרופ' דביר מסביר: "כשמדובר ברקמות שמעבירות סיגנל חשמלי, הן חייבות להיות רקמות מותאמות אישית. ברגע שהן מגיעות ממקור אחר ונשתיל אותן, עלולה להיווצר תגובה של מערכת החיסון. הגוף לא מכיר את אותם תאים, ואז גם אם הרקמה טובה, המערכת החיסונית יוצרת שכבה סביב השתל, שכבה פיברוטית שמורכבת מקולגן וחומרים נוספים. הבעיה היא שהשכבה הזו מפריעה לסיגנל החשמלי לעבור. זה קורה כמעט בכל שתל שאנחנו מכניסים לגוף – שתלי חזה, קוצבי לב. אבל כשמדובר ברקמה שצריכה להעביר חשמל, השכבה הזו מבודדת ופוגעת בתפקוד".
השלב הבא הוא ליצור מהתאים החדשים רקמה שלמה, תהליך שלוקח כחודש. "תאים בודדים, אפילו נוירונים מצוינים, לא יהפכו לרקמה כשמזריקים אותם, הם פשוט לא ישרדו. הם חייבים להיות מסודרים ומאורגנים", מסביר פרופ' דביר. כדי להימנע מכך, החוקרים מפרידים מרקמת השומן של המטופל חומרים כמו קולגנים וסוכרים, ובונים על בסיסם ג’ל מיוחד. "בג’ל הזה, שמותאם אישית כמו התאים עצמם, אנחנו מכניסים את תאי הגזע העובריים ומחקים את ההתפתחות הטבעית של חוט השדרה".
השלב הבא הוא ליצור מהתאים החדשים רקמה שלמה. "תאים בודדים, אפילו נוירונים מצוינים, לא יהפכו לרקמה כשמזריקים אותם, הם פשוט לא ישרדו. הם חייבים להיות מסודרים ומאורגנים", מסביר פרופ' דביר. כדי להימנע מכך, החוקרים מפרידים מרקמת השומן של המטופל חומרים כמו קולגנים וסוכרים, ובונים על בסיסם ג’ל מיוחד. "בג’ל הזה, שמותאם אישית כמו התאים עצמם, אנחנו מכניסים את תאי הגזע העובריים ומחקים את ההתפתחות הטבעית של חוט השדרה".
ואז נותנים להם לגדול. תוך כחודש קורה הקסם, נוצרת רקמה תלת-ממדית שאפשר להשתילה למטופל באזור הפגוע.
בבדיקות שנעשו על בעלי חיים התקבלו תוצאות מעודדות במיוחד: חיות שסבלו משיתוק חמור הצליחו להניע שוב את רגליהן, וחלקן אף חזרו ללכת כמעט באופן מלא. משמעות התוצאות הללו היא שהשתל מצליח לשקם חלק מהקשרים העצביים שנפגעו ולשחזר את העברת האותות מהמוח לשרירים. ממצאים אלה מצביעים על פוטנציאל אמיתי לשיקום תפקודי גם במקרים שנחשבו עד היום לבלתי הפיכים.
כעת ניצב המחקר בפני השלב המרגש ביותר - ניסוי קליני ראשון בבני אדם. הצוות כבר הציג את תוצאותיו למשרד הבריאות, ולאחר בחינה קפדנית התקבל אישור עקרוני לערוך ניסוי חמלה בקרב שמונה מטופלים. פרופ’ דביר מדגיש כי המטופל הראשון יהיה ישראלי: "הטכנולוגיה פותחה כאן, ואני סומך על המנתחים בישראל שיעשו זאת בדרך הטובה ביותר." לאחרונה התקבל גם אישור נוסף להתחיל את שלב איסוף הדם, שיתבצע ברגע שייבחר המטופל המתאים.
בשלב הראשון הניסוי יכלול מטופלים עם פציעות טריות שהשיתוק שלהם נמשך עד כשנה, ולא מקרים קשים שבהם הפגיעה היא ארוכת שנים. "אנחנו רוצים להתחיל בהדרגה, כדי לוודא שהטיפול בטוח ויעיל," מסביר פרופ’ דביר. בהמשך, אם יוכח שהטכנולוגיה עובדת והתוצאות יהיו הדרך לשימוש רחב בה עשויה להיות קצרה בהרבה ממה שנדמה, והיא צפויה להתאים לכלל האנשים הסובלים משיתוק, ללא תלות בגיל או במשך הזמן מאז הפציעה.
"הישג זה מסמן את המעבר ממחקר פורץ דרך לטיפול במטופלים", אומר גיל חכים, מנכ"ל מטריסלף. "בפעם הראשונה אנו מתרגמים שנים של עבודה מוצלחת בפרה־קליניקה לפרוצדורה רפואית עבור אנשים עם שיתוק. השיטה שלנו, שמשתמשת בתאים של המטופל עצמו ליצירת חוט שדרה חדש, מבטלת סיכוני בטיחות מרכזיים וממקמת את מטריסלף בחזית הרפואה הרגנרטיבית. אם נצליח, הטיפול עשוי להגדיר סטנדרט חדש בתחום תיקון חוט השדרה – תחום רפואי שמוערך בשוק עולמי של עשרות מיליארדי דולרים, ושעד היום לא נמצא לו פתרון יעיל. זהו לא רק הישג מדעי אלא נקודת מפנה עבור מטריסלף, צעד ראשון בדרך לשינוי תחום ברפואה שנחשב עד כה לבלתי ניתן לטיפול. אנו גאים בכך שישראל מובילה את המהלך הגלובלי הזה ומחויבים להביא את החידוש הזה למטופלים ברחבי העולם".

מחקר
הבדלים מובהקים בין תגובות שני המינים לתרופה חדשנית למחלות ניוון מוחי כמו מחלת אלצהיימר

תוצאות מחקר חדש באוניברסיטת תל אביב מגלה כי יש הבדלים משמעותיים בין נשים לגברים בתגובה לתרופה ניסיונית למחלות נוירודגנרטיביות כמן אלצהיימר. לדברי צוות המחקר, זוהי הזדמנות חדשה עבור עולם המחקר לשים דגש בתהליך המורכב של פיתוח תרופות, ולהתייחס באופן שונה לגברים ולנשים שייטלו אותן.
המחקר הובל על ידי פרופ' אילנה גוזס מהמחלקה לגנטיקה מולקולרית של האדם וביוכימיה בבית הספר לרפואה ומבית הספר סגול למדעי המוח באוניברסיטת תל אביב, בשיתוף עם הסטודנטים אלכסנדרה לובינצבה וג'ייסון בלאט. המאמר פורסם בכתב העת היוקרתי Translational Psychiatry מבית Nature.
מחלות נוירודגנרטיביות מתאפיינות בהצטברות פתולוגית של החלבון טאו (טאופתיה), בתאי העצב במוח. התרופה הניסיונית שנבדקה, דוונטייד (Davunetide), מבוססת על מקטע של החלבון ADNP החיוני ליצירה ותפקוד המוח, שהתגלה במעבדתה של פרופ' אילנה גוזס בפקולטה לרפואה. יעילותה של התרופה הניסיונית שמגנה מפני טאופטיה במערכות מודל נבחנה עד היום בסדרת ניסויים עבור מגוון מחלות – מאלצהיימר ועד אוטיזם. במחקר הנוכחי בוצע ניתוח נתונים של ממצאי ניסוי קליני מהעבר – עם הפרדה בין גברים לנשים. התוצאות מעידות על הבדל משמעותי בין המינים בהשפעת התרופה.

פרופסור אילנה גוזס
"אצל נשים, התרופה הניסיונית עיכבה את ההתדרדרות באופן משמעותי, הגנה על המוח ואף הפחיתה תסמיני דיכאון, כל זאת בהתאמה למנגנון הפעולה"
"במהלך המחקרים שערכנו בשנים האחרונות הבחנתי בהבדלים משמעותיים בין התוצאות עבור זכרים לעומת נקבות, הן בחיות מעבדה והן בבני אדם," אומרת פרופ' גוזס. "לכן והחלטתי להתבונן בנפרד בשני המינים. המחקר הראשון שבו הופרדו התוצאות עובר גברים ונשים התמקד במחלה הנוירודגנרטיבית PSP (Progressive Supranuclear Palsy). במחלה זו הפתולוגיה המובילה הינה טאופתיה. בניתוח נתונים שבוצע לפני כשנה מצאנו שמצבן של נשים בקבוצת הביקורת (פלסבו) התדרדר מהר יותר בהשוואה לגברים בקבוצה זו; לעומת זאת, אצל נשים, התרופה הניסיונית עיכבה את ההתדרדרות באופן משמעותי, הגנה על המוח ואף הפחיתה תסמיני דיכאון, כל זאת בהתאמה למנגנון הפעולה. במחקר הנוכחי ביצענו ניתוח נתונים נפרד בנשים ובגברים של ממצאים שהתקבלו בעבר מניסוי קליני באנשים מבוגרים עם הפרעות קלות בזיכרון, המעידות על סיכון למחלת אלצהיימר שהינה הטאופתיה הנפוצה ביותר."
הניסוי בחן יכולות של זיכרון קצר חזותי ומילולי בקרב 144 נבדקים מבוגרים, 76 נשים ו-68 גברים. במשך שלושה חודשים טופלו המשתתפים בכל יום בתרסיס לאף של התרופה הניסיונית דוונטייד, ויכולותיהם נבדקו לכל אורך התקופה וגם חודש לאחר הפסקת מתן התרופה. בניתוח הסטטיסטי הנפרד שבוצע לאחרונה, נמצאה יעילות גבוהה בשיפור הזיכרון החזותי אצל גברים - שיפור של 20% בממוצע לעומת התפקוד בתחילת הטיפול, ושיפור של 80% במינון גבוה פי 6 שמעיד על פעילות תלוית מינון ומחזק את הממצאים. בנשים, עקב מתן התרופה במינון הגבוה, נמצא שיפור של כ-10% בממוצע בזיכרון הקשב המילולי וגם ירידה בחרדה, לעומת ירידה קלה בזיכרון המילולי בנשים שקיבלו תרופת דמה.
"הממצאים שלנו מעידים שבתהליך המורכב של פיתוח תרופות חשוב להתייחס בנפרד לגברים ולנשים – במחלות בכלל ובמחלות של המוח בפרט. אנחנו נמשיך לפתח ואת התרופה דוונטייד ואת יעילותה עבור אוכלוסיות שונות ומגוון מחלות (כולל מחלת מוח התפתחותית/ניווניות כמו תסמונת ADNP (שבה מצאנו טאופתיה בגיל צעיר), תוך מתן תשומת לב לשוני בין המינים", מסכמת פרופ' גוזס.
דר' רונן קרייזמן, מנכ"ל חברת רמות מוסיף: "תוצאות מחקר זה פותחות צוהר לתקופה חדשה בפיתוח תרופות, תקופה בה המגדר מהווה משתנה מרכזי בתכנון הניסויים הקליניים ובפיתוח התרופות עצמן. ברמות, אנו גאים לתמוך במחקרים פורצי דרך כגון זה, אשר מרחיבים את גבולות הרפואה ומאפשרים פיתוח טיפולים חדשניים למחלות קשות. ההשקעה שלנו במחקר זה משקפת את מחויבותנו לקידום מדע ומחקר פורץ דרך, ולהבאת תרופות חדשניות לחולים הזקוקים להן".

מחקר
חוקרים מאוניברסיטת תל אביב הצליחו ליישם טיפול גנטי שהצליח לשפר את תפקוד התאים הפגועים במוטציה בגן SHANK3, שמובילה למקרים רבים של אוטיזם בעולם

מחקר חדש ופורץ דרך של צוות מחקר מבית הספר למדעי הפסיכולוגיה מרחיב את ההבנה לגבי הגורמים לאוטיזם שמקורו גנטי, ובפרט מוטציות בגן SHANK3, שאחראיות לכמעט מיליון מקרים של אוטיזם ברחבי העולם. לאור התגליות, יישם צוות המחקר טיפול גנטי שהצליח לשפר את תפקוד התאים שנפגעו מהמוטציה. לדברי החוקרים, בכך הונחה תשתית לפיתוח עתידי של טיפולים יעילים לאוטיזם שמקורו גנטי.
המחקר הובל על ידי מעבדתו של פרופ' בועז ברק והדוקטורנטית ענבר פישר מבית הספר סגול למדעי המוח ומבית הספר למדעי הפסיכולוגיה בפקולטה למדעי החברה ע"ש גרשון גורדון, בשיתוף עם מעבדותיהם של פרופ' בן מעוז מהמחלקה להנדסה ביו-רפואית בפקולטה להנדסה ע"ש איבי ואלדר פליישמן, ופרופ' שני שטרן מהמחלקה לנוירוביולוגיה באוניברסיטת חיפה. המאמר פורסם בכתב העת היוקרתי Science Advances.
"אוטיזם הוא הפרעה נוירו-התפתחותית שכיחה, הנגרמת ממגוון גורמים, בהם מוטציות גנטיות", מסביר פרופ' ברק. במעבדתו נחקרת מוטציה בגן SHANK3, האחראית לכ-1% ממקרי האוטיזם בעולם. "חלבון שמקודד על ידי SHANK3 ממלא תפקיד קריטי בעיגון קולטנים החיוניים לתקשורת בין תאי עצב, ולכן פגיעה בו משבשת את פעילות המוח. המחקר הנוכחי שלנו מתמקד במנגנונים חדשים ולא מוכרים שבהם המוטציה משפיעה על התפתחות המוח, וגורמת לליקויים הקשורים לאוטיזם".
צוות המחקר התמקד בשני מרכיבים במוח שטרם נחקרו לעומק בהקשר זה: תאי תמך שנקראים אוליגודנדרוציטים, ורקמת המיאלין שמיוצרת על ידם. רקמת המיאלין הינה רקמה שומנית העוטפת את שלוחות תאי העצב (אקסונים), ומשמשת כחומר מבודד, בדומה לשכבת הבידוד העוטפת כל כבל חשמלי שאנחנו מכירים. כאשר המיאלין אינו תקין, האותות החשמליים העוברים בשלוחות עלולים לזלוג החוצה, וכך משתבשת העברת המסרים בין אזורי המוח, והתפקוד המוחי נפגע. הצוות נעזר בהנדסה גנטית כדי ליצור מודל לאוטיזם בעכברים, על ידי גרימת מוטציה בגן SHANK3, שזהה בדיוק למוטציה הקיימת אצל בני אדם עם סוג זה של אוטיזם.
"באמצעות המודל מצאנו שהמוטציה בגן גורמת לפגיעה כפולה בהתפתחות ובתפקוד התקין של המוח: ראשית, גילינו שכמו בתאי העצב, גם באוליגודנדרוציטים, החלבון SHANK3 הינו קריטי לעיגון ולתפקוד התקין של קולטנים הקולטים אותות כימיים (נוירוטרנסמיטורים ואחרים) מתאים שכנים. המשמעות היא שהחלבון הפגום המאפיין אוטיזם משבש את העברת המסרים לתאי התמך החיוניים הללו. שנית, בעקבות הפגיעה בתפקוד ובהתפתחות של האוליגודנדרוציטים משתבש גם ייצור המיאלין על ידם. המיאלין הפגום אינו מבודד כראוי את שלוחות תאי העצב, וכך פוגע ביעילות הולכת האותות החשמליים בין תאי המוח ובסנכרון הפעילות החשמלית בין אזורי המוח השונים. במודל שלנו מצאנו פגיעה במיאלין באזורים רבים במוח, וראינו שהתנהגות העכברים נפגעה כתוצאה מכך".

פרופ' בועז ברק והדוקטורנטית ענבר פישר
בהמשך ביקשו החוקרים לבחון שיטה אפשרית לתיקון השיבוש שנגרם על ידי המוטציה, בתקווה שניתן יהיה בעתיד להשתמש בגישה זו גם בבני אדם. "הפקנו אוליגודנדרוציטים ממוח של עכבר עם מוטציה בגן SHANK3, ובאמצעות טיפול גנטי החדרנו לתוך התאים מקטע DNA המכיל את הרצף התקין של הגן SHANK3 האנושי. המטרה הייתה לאפשר לגן התקין לקודד חלבון תקין, אשר יוכל לבצע את התפקיד החיוני בתא, במקום החלבון הפגום. ואכן, לשמחתנו, תאים עם מוטציה שטופלו בטיפול הגנטי ביטאו חלבון SHANK3 תקין, שאיפשר בנייה של מערך חלבונים תקין לעיגון הקולטנים הדרושים לקליטת האותות החשמליים. במילים אחרות: הטיפול הגנטי שפיתחנו תיקן את אתרי התקשורת באוליגודנדרוציטים, אשר חיוניים להתפתחות ולתפקוד תקין של תאים אלה לשם ייצור המיאלין במוח", מסבירה ענבר פישר.
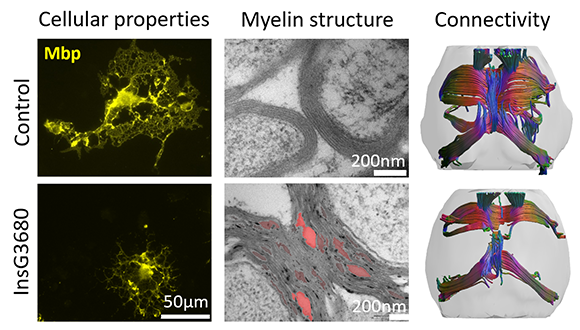
בטור השמאלי: אוליגודנדרוציטים, גדולים ומפותחים ומיצרים מיאלין באופן תקין בחיה בריאה, ואצל חיות המודל לא. בטור האמצעי: צילום במיקרוסקופ אלקטרונים של המיקרוסטרוקטורה של המיאלין. בטור מימין: הקישוריות המוחית. ככל שיש יותר סיבים (אקסונים) ועליהם יותר מיאלין, נראה יותר מסילות צבעוניות שמקשרות בין איזורי מוח שונים
כדי לתקף את הממצאים מעכברי המודל הפיק צוות המחקר תאי גזע מתאי עור של נערה עם אוטיזם כתוצאה ממוטציה בגן SHANK3 (זהה לזו שבעכברים). מתאי גזע אלה יוצרו אוליגודנדרוציטים אנושיים שהמטען הגנטי שלהם זהה בדיוק לזה של הנערה. באוליגודנדרוציטים הללו נמצאו בעיות דומות לאלה שהתגלו במקביליהם העכבריים.
פרופ' ברק מסכם כי המחקר חשף שני מנגנונים חדשים באוטיזם גנטי: פגיעה בתאי התמך מסוג אוליגודנדרוציטים, שמובילה לפגיעה במיאלין. "ממצא זה חשוב להבנת אוטיזם, כיוון שמדגיש את תפקידו של מיאלין פגום במחלה ואת תפקודו של חלבון SHANK3 בשמירה על מצע לקליטת מסרים. בהיבט הרפואי, המחקר מצביע על הצלחת טיפול גנטי לשיפור תפקוד האוליגודנדרוציטים בעכברים, מה שמאפשר תקווה לפיתוח טיפולים גנטיים לבני אדם, אשר יובילו בין היתר לתיקון תהליך ייצור המיאלין במוח. בנוסף, עצם ההבנה שלפגיעה במיאלין יש חשיבות באוטיזם (עם או בלי קשר לגן SHANK3) פותחת כיוונים חדשים להבנת המנגנונים המוחיים המעורבים באוטיזם, כמובן בשאיפה לפיתוח טיפולים עתידיים".

מחקר
חוקרים פיתחו שיטה המבוססת על עקרונות האמנות היפנית העתיקה, כדי למקם חיישנים בתוך רקמות ביולוגיות שהודפסו במדפסות תלת ממד

חוקרים באוניברסיטת תל אביב הסתמכו על עקרונות אמנות האוריגמי היפנית כדי לפתח פתרון מקורי, חדשני ויעיל לבעיה שמטרידה כיום חוקרים בכל העולם: כיצד למקם חיישנים בתוך רקמות ביולוגיות שהודפסו במדפסות תלת ממד. במקום להדפיס את הרקמה על גבי החיישנים הרצויים (פעולה שנדונה לכישלון), הם תחילה מתכננים במחשב ואחר כך מייצרים בפועל מבנה מבוסס-אוריגמי שמולבש על הרקמה מבחוץ, ומחדיר את החיישנים בדיוק למקומות הנכונים.
המחקר בוצע על ידי חוקרים מבית הספר לנוירוביולוגיה, ביוכימיה וביופיזיקה, מהמרכז לננו-מדע וננוטכנולוגיה, מהמחלקה להנדסה ביו-רפואית בפקולטה להנדסה ע"ש איבי ואלדר פליישמן, ממרכז סגול לרפואה רגנרטיבית, ומבית ספר סגול למדעי המוח באוניברסיטת תל אביב. צוות החוקרות והחוקרים: נועם רהב , עדי סופר, פרופ' בן מעוז, פרופ' אורי אשרי, דניס מררו, אמה גליקמן, מגן בלדג'יללי-לברו, יקי יפה, קשת תדמור, ויעל לייכטמן-ברדוגו. המאמר פורסם בכתב העת היוקרתי Advanced Science.
"חוקרים בכל העולם כבר משתמשים במדפסות תלת ממד כדי להדפיס רקמות ביולוגיות לצורכי מחקר. בטכנולוגיה הקיימת ראש המדפסת נע הלוך ושוב, ומדפיס שכבה אחר שכבה של הרקמה המבוקשת. אך לשיטה זו הייתה עד היום בעיה מהותית: לא ניתן להדפיס את הרקמה על גבי מערך חיישנים שיספק לחוקר מידע חיוני על התאים שבתוכה , זאת מכיוון שהראש המדפיס שובר את החיישנים. אנחנו החלטנו לגשת לבעיה המורכבת מכיוון שונה וחדש: אוריגמי", מסביר פרופ' מעוז.
בבסיס הפיתוח החדשני עומד שילוב מקורי ומרתק בין מדע לאמנות. בעזרת תוכנת CAD – תכנון בעזרת מחשב, החוקרים מתכננים מבנה המותאם ספציפית לרקמה המודפסת, על סמך עקרונות קיפולי האוריגמי. מבנה זה משלב בתוכו חיישנים לבדיקת פעילות חשמלית או התנגדות חשמלית של תאים בכל מקום שנבחר בתוך הרקמה. הדגם שבמחשב משמש לייצור מבנה פיזי, אותו מקפלים סביב הרקמה המודפסת, כך שכל חיישן חודר לרקמה ומונח בתוכה בדיוק במקום הנכון. הפלטפורמה החדשנית נקראת MSOP ((multi-sensing origami platform - פלטפורמת אוריגמי מרובת-חיישנים.
הוכחת ההיתכנות של השיטה החדשנית בוצעה ברקמת מוח מודפסת, והחיישנים שהוחדרו לרקמה הקליטו פעילות חשמלית של תאי עצב. עם זאת, החוקרים מסבירים שהמערכת היא ורסטילית ומודולרית: היא מאפשרת לשלב כל סוג ו/או מספר חיישנים, בכל מקום שנבחר, בכל סוג של רקמה ביולוגית מודפסת, וגם ברקמות ביולוגיות שגודלו במעבדה לצורכי מחקר, כמו לדוגמה מוחון – כדור קטן המורכב מנוירונים ומדמה מוח אנושי.
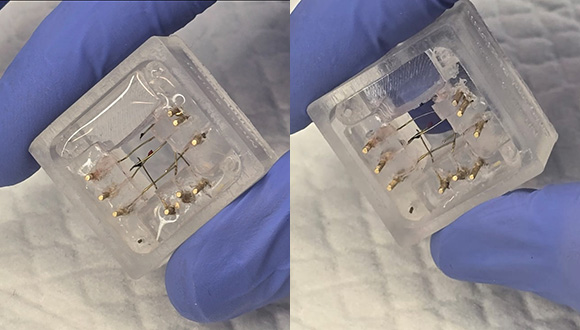
לפני ואחרי. מימין: השבב עם החיישנים, משמאל: לאחר השתלת הרקמה המודפסת על החיישנים
"במחקר הראינו שבניסויים על רקמות מוח מודפסות, יש למערכת יתרון נוסף: ניתן להוסיף לה שכבה המחקה את מחסום הדם-מוח - אותו קרום שמגן על המוח מחדירת חומרים בלתי רצויים, אך חוסם גם תרופות מסוימות שנועדו למחלות מוח. השכבה שאנו מוסיפים עשויה מתאי מחסום דם-מוח אנושי, ומאפשרת לבחון את רמת ההתנגדות החשמלית של תאי המחסום, המעידה על מידת החדירות שלו לתרופות", מוסיף פרופ' מעוז.
"במחקר שלנו יצרנו שילוב 'מחוץ לקופסה' בין מחקר מדעי לאמנות. פיתחנו שיטה המבוססת על קיפולי אוריגמי, שמאפשרת להחדיר חיישנים למקומות מדויקים בתוך רקמה ביולוגית מודפסת, וכך לקלוט ולהקליט את פעילות התאים והתקשורת ביניהם. טכנולוגיה זו מהווה צעד חשוב בקידום המחקר הביולוגי בכל העולם", מסכמים החוקרים.

מחקר
שתי תגליות מפתיעות: בניגוד להשערה הרווחת, עטלפים כן סובלים מירידה בשמיעה עם הגיל, אך ככל הנראה יש להם מנגנונים מפתיעים שמסייעים להם להאט את קצב איבוד השמיעה

תושבות ותושבי הערים הגדולות כבר רגילים לרעשי הכרך התעשייתיים, שנחשבים חלק בלתי נפרד מהחיים בעיר ונחשבים למזיקים לשמיעה. אבל מסתבר שיש מי שנהנה ממנגנונים המסייעים לו בהגנה מנזקי רעש, ואלו הם העטלפים: מחקר חדש של אוניברסיטת תל אביב מפריך את הסברה של חוקרים רבים בקהילה המדעית, שלפיה עטלפים חסינים מפני אובדן שמיעה בגיל מבוגר (תופעה שמאפיינת יונקים רבים). במחקר הנוכחי, צוות החוקרים קובע כי איכות השמיעה של העטלפים אכן נפגעת, אך כיוון שהם חיים במושבות רועשות במיוחד, ייתכן שהם פיתחו יכולת להאט את אובדן השמיעה לעומת בני אדם ויונקים אחרים. אולי יש גם לנו נחמה בחיים לצד תחנות אוטובוס ואתרי בניינים מתחדשים?
בעבר, רווחה הסברה השגויה כי לאור חשיבותה של השמיעה למערכת הסונר של העטלפים הם שומרים על איכות שמיעה טובה שמאפשרת להם להתמצא במרחב, גם בגילאים מתקדמים. "אך למרות שהשמיעה בתדר גבוה מעניקה יתרון הישרדותי לבעלי חיים רבים, והיא חיונית להישרדותם של עטלפים - עד היום, אף מחקר לא בדק באופן שיטתי את השפעת הגיל על השמיעה אצל עטלפים" אומר פרופ' יוסי יובל, ממובילי המחקר.
המחקר נערך בהובלת תלמידת הדוקטורט, יפעת טרנובסקי מהמעבדה של פרופ' יוסי יובל, נוירו-אקולוג מבית הספר לזואולוגיה וראש בית הספר סגול למדעי המוח ובשיתוף דיקאנית הפקולטה לרפואה ע"ש סאקלר, פרופ' קרן אברהם וד"ר שחר טייבר מצוות המעבדה שלה. כמו כן השתתפו במחקר עמיתים מאוניברסיטת מרילנד. המחקר פורסם בכתב העת Life Science Alliance.
במסגרת המחקר, החוקרים העריכו תחילה במחקרם את גילם של 47 עטלפי פירות מצריים (Rousettus aegyptiacus), על ידי מדידת הצטברות מתילציות (תהליך שבו קבוצת מתיל מחליפה אטום מימן) של מולקולות ה-DNA של החיות. לאחר מכן, החוקרים בדקו את שמיעתם של העטלפים על ידי ניטור תגובות חשמליות במוחם לצלילים בתדר ובעוצמה משתנים. ההקלטות הראו ירידה ברורה בשמיעה, הקשורה בגילם של העטלפים, וכמו אצל בני אדם, הירידה בלטה במיוחד בתדרי צליל גבוהים יותר. כמו כן, שיעור אובדן השמיעה ביחס לגילם של העטלפים, היה דומה מאוד לשיעור הנצפה בבני אדם מזדקנים.
בדיקות נוספות הצביעו על כך שבדומה לבני אדם, עטלפים חווים ירידה בשמיעה הקשורה במבנה השבלול ובתפקודו, כמו גם ירידה במהירות העיבוד של עצב השמיעה. "סימפטום אחרון זה", מסבירה טרנובסקי, "עלול לפגוע בהבנת הדיבור בבני אדם, ועלול להקשות על השימוש בסונר בקרב עטלפים מבוגרים. עטלפי הפירות המצריים שחקרנו מסתמכים על הד כאשר הם מבצעים משימות שונות, אבל הם גם מסתמכים במידה רבה על ראייה כשמתאפשר להם. לכן יש לשחזר את הבדיקות שביצענו במחקר, הפעם בעטלפים עם ראייה ירודה, שעבורם איכון-הד הוא כמעט מנגנון ההתמצאות היחיד".
כמו כן, החוקרים מעריכים כי אחד הגורמים האפשריים לאובדן השמיעה בקרב עטלפי הפירות המצריים הוא החשיפה המצטברת לרמות רעש גבוהות בסביבתם. כמו מיני עטלפים רבים אחרים, עטלפי פירות מצריים חיים במושבות גדולות ומשמיעים קריאות חברתיות תכופות ורועשות. טרנובסקי ועמיתיה הציבו מספר מיקרופונים בתוך מערת עטלפי הפירות וגילו כי הם נחשפים באופן תדיר ליותר מ-100 dB, עוצמה השווה לרעש של אופנוע או מסור חשמלי. למרבה ההפתעה, הרעשים החזקים ביותר היו בתדרים נמוכים, ואילו הבדיקות שנערכו הראו כי אובדן השמיעה מתבטא בעיקר בתדרים גבוהים.
"השילוב בין רמות הרעש הגבוהות מאוד שאליהן נחשפים עטלפי פירות לבין הקצב המתון (בדומה לבני אדם) של אובדן שמיעה הקשור בגיל, מצביע על כך שלעטלפים עשויות להיות התאמות מיוחדות להתמודדות עם סביבתם הרועשת", מסכם פרופ' יובל. החוקרים מקווים כי הבנת ההתאמות הללו תוכל לספק תובנות באשר למנגנוני אובדן השמיעה הקשור בגיל בקרב בני אדם.

פרופ' יוסי יובל ושני חברים מכונפים

מחקר
חוקרים מאוניברסיטת תל אביב מיפו בגנום גורמי סיכון למחלת העיניים המורכבת AMD

חוקרים מאוניברסיטת תל אביב זיהו גורם חדש לסיכון גנטי למחלת העיניים המורכבת AMD, שמהווה גורם מוביל לאובדן ראייה בגיל מבוגר. במסגרת המחקר, הצליחו החוקרים לאשונה לזהות חלבונים שתפקידם חיוני להתפתחות ולפעילות הרקמה שנפגעת במחלה, לאתר במדויק את מיקומם באזורים גנומיים שמחוץ לגנים ולזהות את הקשר בין השינויים באזורים אלה לבין הסיכון לחלות ב-AMD. לדברי צוות המחקר, התגלית מעמיקה את ההבנה בנוגע לתפקידם של אזורים בגנום שמחוץ לגנים, שעד כה היו בגדר תעלומה. השיטה החדשה עשויה לאפשר פיענוח של מנגנונים גנטיים נוספים המעורבים במגוון מחלות גנטיות מורכבות.
המחקר נערך בהובלת פרופ' רות אשרי-פדן ופרופ' רני אלקון מהמחלקה לגנטיקה מולקולרית של האדם וביוכימיה בפקולטה לרפואה ע"ש סאקלר ובית ספר סגול למדעי המוח וצוות החוקרים במעבדות בהובלת מזל כהן גולקר, נעמה מסיקה, אהובית דוד ומאי אשל. המאמר פורסם בכתב העת PLOS Biology.
"אחד האתגרים הגדולים בחקר הגנטיקה כיום הוא פיענוח מנגנונים גנטיים שגורמים למחלות מורכבות, כלומר כאלה שאינן נגרמות על ידי פגם בגן ספציפי ומזוהה, אלא על ידי שילוב של מספר גורמים גנטיים וסביבתיים", מסבירה פרופ' אשרי-פדן ומרחיבה "מדובר במגוון רחב מאוד של מחלות, בהן סוכרת, מחלות מעי ומחלות נפש לסוגיהן. במחקר שלנו התמקדנו במחלת העיניים AMD (Age-related Macular Degeneration), או בשמה העברי 'ניוון מקולרי גילי', שבה מתנוון אזור מרכז הרשתית. המחלה פורצת על פי רוב בגיל המבוגר ומהווה גורם מוביל לאובדן ראייה בעולם המפותח".
"ל-AMD יש מרכיב גנטי משמעותי. מחקרים שהשוו בין הגנום של אנשים חולים ובריאים זיהו הבדלים במספר אזורים בגנום, שקשורים ככל הנראה לגורמי סיכון למחלה. עם זאת, ההבדלים בגנום לא אותרו בתוך גן ספציפי כלשהו, אלא באזורים הנרחבים שבין הגנים, שתפקידם ואופן תפקודם אינם מוכרים למדע עד היום. מצב דומה התגלה במגוון רחב של מחלות גנטיות מורכבות נוספות. למעשה, המצב כיום הוא שמחקרים השוואתיים יודעים לזהות אזורים שלמים בגנום שככל הנראה קשורים למחלה, אך קשה מאוד לשים את האצבע על מאפיין מסוים באותם אזורים, ולהגדירו כגורם סיכון. במחקר שלנו ביקשנו לתת מענה לסוגיה זו", מוסיף פרופ' אלקון.
המחקר התמקד בתאים של רקמה בעין המכונה אפיתל פיגמנטרי, שהיא רקמת תמך התומכת בקולטני האור ברשתית (פוטורצפטורים), וחיונית להתפתחותם ולהישרדותם לכל אורך החיים. לדברי החוקרים, רקמה זו נפגעת כבר בשלבים הראשונים של מחלת ה-AMD.
"ראשית, ביקשנו להבין את המנגנון הגנטי שמפעיל ומבקר את הפעילות הייחודית של תאי האפיתל הפיגמנטרי. באמצעות סדרת ניסויים שכללה ביטול חלבונים שונים במודל של עכברים ובתאים אנושיים, הצלחנו לזהות שני חלבונים מרכזיים הקרויים LHX2 ו-OTX2, שמכתיבים יחדיו את ביטוים של גנים רבים שהם ייחודיים לרקמה זו. מדובר בחלבונים מסוג 'חלבוני שיעתוק', שתפקידם להיקשר לאתרים מסוימים ב-DNA שבתא, ובדרך זו לקבוע אילו גנים יתבטאו באותו תא", מסבירה פרופ' אשרי-פדן.
האתגר הבא היה למפות היכן בדיוק בגנום ממוקמים שני החלבנים. לשם כך נעזרו החוקרים בטכנולוגיה החדשנית בשם ChIP-seq, שהיא שיטת ריצוף המאפשרת זיהוי של אתרי קישור בהם נקשרים חלבונים ל-DNA. פרופ' אלקון: "מצאנו ששני החלבונים נקשרים לאתרים סמוכים זה לזה בגנום. יותר מכך, התברר שמדובר באתרים בגנום שזוהו בעבר כקשורים לגורמי סיכון ל-AMD (כלומר רצפים שנמצאו בהם הבדלים בין אנשים בריאים לחולים). אנחנו משערים שבעקבות השינויים ברצפי ה-DNA באותם אזורים מתקשים חלבוני השיעתוק לזהות את אתרי הקישור על פני הגנום ולהיקשר אליהם. כתוצאה משיבוש זה יורד ביטויו של הגן הסמוך המבוקר על ידי חלבוני השיעתוק (ידוע כי הגן מקודד תעלת יונים בעלת חשיבות לתפקוד העין). הירידה בפעילות הגן פוגעת ברקמה כולה, וכך עולה הסיכון להתפתחות המחלה."
"במחקר שלנו זיהינו שני חלבונים הקשורים לגורמי סיכון למחלת העיניים הגנטית המורכבת AMD. כמו כן הצלחנו למפות לראשונה את מיקומם של החלבונים האלה בגנום, ומצאנו כי הם פועלים באזור שזוהה בעבר כקשור לסיכון ללקות במחלה. הממצאים שלנו מעמיקים את הבנתנו בנוגע לתפקידם ולאופן תפקודם של רצפים גנומיים שנמצאים מחוץ לגנים, שהיו עד היום בגדר תעלומה, וכיצד הם מעורבים במחלות גנטיות מורכבות. אנחנו מאמינים ששיטת המחקר החדשנית שהניבה את ההצלחה תאפשר בעתיד זיהוי ומיפוי של מנגנונים גנטיים רבים נוספים הקשורים למחלת ה-AMD ולמחלות גנטיות מורכבות אחרות", מסכמת פרופ' אשרי-פדן.

פרופ' רות אשרי-פדן

מחקר
אפשר לקבוע שייכות פוליטית לפי ההבדלים בפעילות המוחית בעת צפייה בסרטוני בחירות

מחקר ראשון מסוגו סרק את המוח של עשרות נבדקים מעורבים פוליטית, בעת שצפו בתשדירים ובנאומים של מפלגות משני קצוות הקשת הפוליטית, ממש לפני אחד מסבבי הבחירות האחרונים. הנבדקים, מחציתם מזוהים עם הימין והיתר עם השמאל, הוכנסו למכונת דימות (fMRI), שמדדה את הפעילות באזורים השונים של המוח. התוצאות המפתיעות מגלות: די היה להתבונן בפעילות המוחית כדי לנבא את הדעות הפוליטיות של הנבדקים, היות וההבדלים בין נבדקים ימנים ושמאלנים מתחילים כבר באיזורים ראשונים, שהם אזורי הראיה והשמיעה.
המחקר נערך בהובלת תלמידת המחקר נועה קעטבי מהמעבדה של ד"ר יערה ישורון מבית הספר למדעי הפסיכולוגיה ומבית ספר סגול למדעי המוח. המחקר פורסם בכתב העת Journal of Neuroscience.
במהלך המחקר, החוקרות הקרינו לנבדקים סדרת סרטונים. הראשון שימש לצרכי ביקורת והיה נייטרלי וללא סממנים פוליטיים, והאחרים כללו תשדירים ונאומים של פוליטיקאים בכירים משני הגושים, ימין ושמאל. להפתעתן של החוקרות, המחקר הראה שהמוחות של הנבדקים הסתכרנו עם הסרטונים בהתאם לשייכות הפוליטית, כך שכאשר מצביעי הימין צפו בסרטונים של מנהיגים מהגוש שלהם נרשמה באיזורים מסוימים במוחות שלהם פעילות ערה וזהה, וכך גם לגבי מצבעי השמאל. הנבדקים הימנים היו מסונכרנים בפעילות המוחית שלהם, כלומר האזורים שהיו פעילים במוח עבדו בצורה דומה, כאשר צפו בסרטונים של הימין, ואילו אל של המוחות של השמאלנים היו מסונכרנים כשצפו בסרטונים של השמאל, לרבות באזורים הסנסוריים, המוטוריים והסומטו-סנסוריים - איזורים תחושתיים ראשוניים שאחראים על קבלת מידע מהסביבה באמצעות ראייה, שמיעה, תנועה וחישה.
כמו כן, החוקרות זיהו שבמיגוד לממצאי מחקרים קודמים שעסקו בהבדלים בפעילות המוחית של אנשים שהיו בעלי דעות שונות לגבי הגירויים שהוצגו להם - במחקר הנוכחי הסנכרון המוחי אינו מוגבל לאזורים "גבוהים" במוח, שעוסקים בפרשנות ובחשיבה מופשטת, אלא שהגירוי סנכרן את הנבדקים כבר באזורים במוח שאחראים על קליטת הגירוי עצמו: הראייה, השמיעה ואפילו המישוש.
"אני חושבת שאם ננסה להבין מהי המציאות שאותה חווים א.נשים שמחזיקים בדעה הפוליטית שהפוכה לדעתנו, אילו גירויים מגיעים אליהם עוד לפני שניכנס לדיונים התיאורטיים והערכיים – אולי נצליח לנהל דיון ציבורי קצת יותר אפקטיבי"

ד"ר יערה ישורון
"המחקר הראה בבירור שככל שהנבדקים היו מזוהים פוליטית עם גוש מסוים, כך הסנכרון המוחי הלך והתהדק, גם באזורים מוטוריים וסומטו-סנסוריים, כלומר האזורים במוח שפעילים כשאנו נעים או חשים דברים בעזרת החושים שלנו. למעשה, רק לפי התגובה המוחית באיזורים חושיים ראשוניים יכולנו להגיד אם מי שצופה בסרטון מסוים הוא בעמדה פוליטית כזו או אחרת. מה שמעניין כאן הוא שלא היה צריך לבחון את הפעילות באיזורים מוחיים "גבוהים"– איזורים שמעורבים בהבנה של למה דמות מסויימת עשה משהו, או מה אותה דמות חושבת ומרגישה – כדי לנבא את הדעה הפוליטית של הנבדקים", מסבירה ד"ר ישורון.
לדעת החוקרות, מדובר בממצא מפתיע שנובע מהעובדה שהנבדקים שנבחרו היו מעורבים פוליטית, ובעקבות תזמון הניסוי, שהתקיים שבועות ספורים לפני הבחירות, כאשר האווירה הפוליטית בארץ הייתה מאוד נוכחת ואמוציונאלית.
"זו הפעם הראשונה שבה נמדדה פעילות מוחית שונה באזורי ראייה ושמיעה ובאזורים המוטוריים לפי חלוקה פוליטית. אפשר לומר שברמה המוחית הבסיסית ביותר, ימנים ושמאלנים בישראל רואים וחווים את המציאות אחרת. אני חושבת שאם ננסה להבין מהי המציאות שאותה חווים א.נשים שמחזיקים בדעה הפוליטית שהפוכה לדעתנו, אילו גירויים מגיעים אליהם עוד לפני שניכנס לדיונים התיאורטיים והערכיים - אולי נצליח לנהל דיון ציבורי קצת יותר אפקטיבי", מסכמת ד"ר ישורון.
ימין או שמאל? "אם ננסה להבין מהי המציאות שאותה חווים א.נשים שמחזיקים בדעה הפוליטית שהפוכה לדעתנו, אילו גירויים מגיעים אליהם עוד לפני שניכנס לדיונים התיאורטיים והערכיים - אולי נצליח לנהל דיון ציבורי קצת יותר אפקטיבי"

מחקר
לראשונה בעולם המדע רובוט הצליח "להריח" באמצעות חיישן ביולוגי

אחרי שפיתחו את הרובוט הראשון ששומע באמצעות אוזן ביולוגית, החוקרות והחוקרים של אוניברסיטת תל אביב העניקו לרובוט חוש נוסף: חוש הריח. פריצת הדרך המדעית מאפשרת לרובוט להריח באמצעות חיישן ביולוגי, לזהות האם נמצא בסביבתו ריח ולשלוח בתגובה אותות חשמליים שאותם הוא יודע לקרוא. החוקרים חיברו בהצלחה חיישן ביולוגי למערכת אלקטרונית ובעזרתה, תוך שילוב של אלגוריתם למידת מכונה, הצליחו להפריד ריחות ברגישות הגבוהה פי 10,000 ממכשירים אלקטרוניים קיימים. התקווה היא שבעתיד יוכל רובוט שמצויד בחושים אלו לשמור על חיי אדם ולזהות סכנות רבות, החל מחומרי נפץ וסמים, דרך זיהוי מחלות וכלה באסונות טבע. "השמיים הם הגבול", אומרים החוקרים.
הרובוט הראשון בעל האף הביולוגי. רק באוניברסיטת תל אביב.
"אנו עוברים במגנומטר שעולה מיליוני דולרים ויודע להגיד אם אנו נושאים עלינו מתכות. אבל כשרוצים לבדוק אם נוסע מבריח סמים - מביאים כלב שירחרח אותו"
פריצת הדרך הביולוגית והטכנולוגית נעשתה בהובלת הדוקטורנטית נטע שביל מבית הספר סגול למדעי המוח, ד"ר בן מעוז מהפקולטה להנדסה ע"ש איבי ואלדר פליישמן ובית הספר סגול למדעי המוח, פרופ' יוסי יובל ופרופ' אמיר אילי מבית הספר לזואולוגיה ובית הספר סגול למדעי המוח. תוצאות המחקר התפרסמו בכתב העת היוקרתי Biosensor and Bioelectronics.
ד"ר מעוז ופרופ' אילי מסבירים: "ישנן טכנולוגיות שלא יכולות להתחרות במיליוני שנות אבולוציה. תחום אחד שבו אנו מפגרים במיוחד אחרי עולם החי הוא תחום חישת ריחות. דוגמה לכך אפשר למצוא בנמלי התעופה. כשאנו טסים לחו"ל, אנו עוברים במגנומטר שעולה מיליוני דולרים ויודע להגיד אם אנו נושאים עלינו מתכות. אבל כשרוצים לבדוק אם נוסע מבריח סמים - מביאים כלב שירחרח אותו. בתוך עולם החי, חרקים מצטיינים בקליטת ובעיבוד אותות חושיים . יתוש, למשל, יודע לזהות הפרש של 0.01% ברמת הפחמן הדו-חמצני באוויר. כיום אנחנו רחוקים מלייצר חיישנים שיתקרבו ביכולות שלהם לחושים של חרקים".
החוקרים מציינים שככלל, איברי החישה שלנו ושל כל שאר בעלי החיים, כמו העין, האוזן והאף, משתמשים בקולטנים שמזהים ומפרידים בין אותות שונים. בשלב השני, איבר החישה מתרגם את הממצאים לאותות חשמליים שהמוח מפענח כמידע. האתגר בביו-סנסורים הוא בחיבור איבר חישה כמו האף למערכת אלקטרונית שתדע לפענח את האותות החשמליים שמתקבלים מהקולטנים.

הדוקטורנטית נטע שביל וד"ר בן מעוז
רגיש לריח פי 10,000
"חיברנו את החיישן הביולוגי ואפשרנו לו להריח ריחות שונים תוך כדי שאנחנו מודדים את הפעילות החשמלית שמעורר כל ריח וריח", מסביר פרופ׳ יובל. "המערכת אפשרה לנו לקבל זיהוי של כל ריח כבר ברמת איבר החישה הראשוני של החרק. בשלב השני השתמשנו בלמידת מכונה כדי ליצור 'ספרייה' של ריחות. במחקר הצלחנו לאפיין 8 ריחות, כגון גרניום, לימון ומרציפן, באופן שיכולנו לדעת מתי מוצג ריח לימון ומתי מרציפן. למעשה, אחרי שהניסוי נגמר המשכנו וזיהינו ריחות נוספים, שונים ומשונים, כמו למשל מיני ויסקי סקוטי שונים. השוואה למכשירי מדידה סטנדרטים הראתה שהרגישות של החיישן הביולוגי במערכת שלנו גבוהה פי כ-10,000 ממכשירים שנמצאים היום בשימוש".
"הטבע מתקדם מאיתנו בהרבה, לכן כדאי להשתמש בו. ניתן להשתמש בעיקרון שהצגנו וליישם אותו על חושים אחרים כמו ריח, ראייה ומישוש. לדוגמה, לבעלי חיים מסוימים יש יכולות מדהימות לזיהוי של חומרי נפץ וסמים, וייצור של רובוט עם מחוש ביולוגי יוכל לעזור לנו לשמור על חיי אדם ולזהות עבריינים באופן שלא ניתן כיום. יש בעלי חיים שיודעים לזהות מחלות ואחרים שיודעים לחוש רעידות אדמה. השמיים הם הגבול", מסכם ד"ר מעוז.
בעתיד, החוקרים מתכננים לשלב ברובוט גם יכולות ניווט שיאפשרו לו לאתר את המקור של הריח ולאחר מכן גם את סוגו.

האם בקרוב יוכל לצאת לפנסיה? כלב עבודה מחפש חומרים מסוכנים בשדה התעופה