נמצאו ראיות ראשונות לשימוש בכלים ממוחזרים זעירים בארץ ישראל של לפני חצי מיליון שנה

מחקר
נמצאו ראיות ראשונות לשימוש בכלים ממוחזרים זעירים בארץ ישראל של לפני חצי מיליון שנה

"יש לנו תדמית של בני אדם קדומים כיצורים מגושמים וגדולים שמתנפלים על הפיל עם כלי אבן גדולים, זוללים כמה שאפשר לזלול, ממלאים את הבטן ואז הולכים לישון. למעשה, תהליך הביתור היה מורכב בהרבה מכפי שחשבנו." אומר פרופ' רן ברקאי, מהחוג לארכיאולוגיה ותרבויות המזרח הקדום באוניברסיטת תל אביב, לאור ממצאים חדשים שנמצאו באתר הפרהיסטורי רבדים שבמרכז הארץ.
צוות בינלאומי של חוקרים, בהובלת ד"ר פלאביה ונדיטי ופרופ' ברקאי, ערכו ניתוחים חדשניים לנתזי צור זעירים בני 300 עד 500 אלף שנה. מהניתוח המיקרוסקופי וניתוח השיירים האורגניים שזוהו על כלי הצור הקטנטנים, החוקרים מסיקים שנתזי הצור לא היו פסולת תעשייתית, שנותרה מייצור כלים גדולים יותר, אלא תוצאה מכוונת ומושכלת של מיחזור כלי צור קיימים – מיחזור ששימש את תושבי האתר לביתור כירורגי של פילים ובעלי חיים נוספים.
"מדובר בניתוחים חדשניים של פריטי צור ישנים, מהתקופה הפליאוליתית התחתונה, הכוללים תצפיות מיקרוסקופיות אחר סימני שימוש – use-wear analysis – ואחר שיירים אורגניים – residue analysis", מסביר פרופ' ברקאי. "בעצם חיפשנו סימני שחיקה, שבירה, שריטה ואפילו שיירים אורגניים שנותרו בקפלים של נתזי הצור, והכול במטרה להבין למה הם שימשו".
האתר ברבדים, בין צומת שמשון לצומת נחשון, מיוחס לבני אדם ממין הומו ארקטוס ולתרבות האשלית. תרבות זו, שנפוצה באפריקה, באירופה ובאסיה, התאפיינה בייצור תקני, מוקפד ואסתטי של כלי אבן, כמו אבני היד ששימשו בעיקר לביתור בעלי חיים גדולים. יצוין כי בני אדם קדומים היו תלויים בבשר ובעיקר בשומן של בעלי חיים לקיומם, ומכאן שהייתה חשיבות עליונה לביתור איכותי של בעלי החיים הגדולים והפקת כל קלוריה אפשרית מהם. הכלים שנמצאו באתר רבדים השתמרו היטב, ופרופ' ברקאי וצוותו כבר מצאו בעבר גם סימני שימוש וגם שיירים אורגניים על כלים גדולים. כעת, לראשונה, החוקרים הוכיחו שגם לנתזים הקטנטנים היה שימוש חשוב – וכן שהם מוחזרו בכוונה מכלי אבן גדולים יותר שיצאו מכלל שימוש וננטשו.
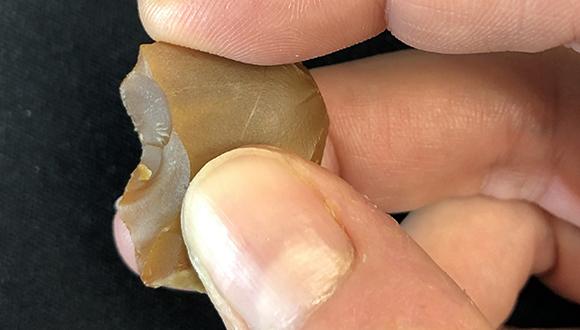
"לראשונה יש לנו תוצאות שמוכיחות שימוש בנתזים קטנטנים באורך של כשלושה ס"מ בסך הכול", אומר פרופ' ברקאי. "אלה כלים שיוצרו בתהליך של מיחזור: בני האדם הקדומים לקחו פריטי צור שיצאו מכלל שימוש ומיחזרו אותם למטרות אחרות. במשך עשרות שנים הנתזים הקטנטנים לא זכו לתשומת לב במחקר הארכיאולוגי, והדגש במחקר היה על כלי האבן הגדולים, המעוצבים, המסותתים, המושקעים והמרשימים. אנחנו מראים כאן שהכלים הזעירים יוצרו בכוונה והיו בעלי תפקיד חשוב בארגז הכלים של בני האדם הקדומים".
לאחר מחקר בן שלוש שנים וניתוחים מיקרוסקופיים של מאות נתזי צור קטנטנים מהאתר של רבדים, החוקרים מצאו 107 נתזים קטנטנים שעליהם סימני שימוש מביתור בעלי חיים. בנוסף לסימני השחיקה, על 11 מתוך ה-107 הנתזים נמצאו גם שיירים אורגניים – בעיקר של עצם, אבל גם של רקמות רכות.
ניסויים שבוצעו בהעתקים של הכלים הארכיאולוגיים לימדו שהנתזים הקטנים יעלים מאוד בביצוע מלאכות ביתור עדינות ומדויקות, ושהם שימשו לפרק זמן קצר מאוד. ככל הנראה, הכלים הזעירים שימשו בשלבים ספציפיים של הביתור, שהצריכו פעולות חיתוך מדויקות, כמו הפרדת גידים. יש להניח שהנתזים הקטנים שימשו לצד הכלים הגדולים יותר בביתור בעלי חיים באתר, בין היתר לביתור פילים – שהיו מקור המזון העיקרי ברבדים.
"הנתזים הזעירים היו כלים כירורגיים שיוצרו ושימשו לחיתוך עדין ומדויק של חלקים ייעודיים בגוף הפיל, במטרה להפיק כל קלוריה אפשרית, וכן חומרים כמו גידים ועור, מבעלי החיים הניצודים." מסביר ברקאי, "הפעולות הללו משקפות תרבות מעודנת, מדויקת, מחושבת וסביבתית. הקולגות האמריקאים שלי לא יאהבו את זה, אבל לי אין ספק שהייתה להם מודעות סביבתית מפותחת. הם מחזרו את הכלים שלהם הרבה לפנינו והם לא בזבזו מזון כמונו. למעשה, הם לא בזבזו דבר. אני בטוח שהחשיבה האקולוגית הזו היא שאפשרה לבני האדם הקדומים לשגשג במשך מאות אלפי שנים".
מחקר
חוקרים גילו את המנגנון המרכזי שגורם לעמידות סרטן המלנומה לטיפולי אימונותרפיה, וכעת ישפרו את סיכויי ההצלחה של הטיפול

בשנים האחרונות הפכו טיפולי האימונותרפיה לשיטת הטיפול המקובלת לסרטן מסוג המלנומה גרורתית – סרטן עור ממאיר וקשה מאוד לטיפול. בטיפולי אימונותרפיה, מקבל החולה תרופות המפעילות את מערכת החיסון שלו ומגייסות אותה למלחמה בגידול הסרטני. הבעיה היא, שטיפול זה אינו יעיל בכל המקרים, ומצליח להביא לנסיגת המחלה רק אצל חלק מהחולים. חוקרים באוניברסיטת תל אביב ובמרכז הרפואי שיבא, חשפו מנגנון מרכזי הגורם לעמידות מלנומה גרורתית לאימונותרפיה, ומקווים כעת להתקדם ולטפל בגורמים שהופכים את הסרטן לעמיד בפני הטיפול.
חוקרים מבית הספר לרפואה ע"ש סאקלר ובמרכז הרפואי שיבא, בהובלת פרופ' תמי גיגר, פרופ' גל מרקל וד"ר מיכל הראל, מצאו תשובה לשאלה שמעסיקה מאוד את האונקולוגים: מדוע טיפולי אימונותרפיה משפיעים רק על חלק מהחולים בסרטן המלנומה גרורתית? נכון להיום, רק כשליש מהחולים המטופלים באימונותרפיה מגיבים לטיפול.
"טיפולים האימונותרפיה הוכחו כיעילים ביותר עבור חלק מהחולים, וחוללו מהפכה תפישתית באונקולוגיה. עם זאת, במקרים רבים הטיפולים הקיימים נכשלים, והמטרה שלנו הייתה להבין כיצד ניתן לנבא מי יגיב להם ומי לא, ואולי לשנות משהו על מנת להגדיל את שיעור התגובה", מסביר פרופ' מרקל, אונקולוג בכיר והמנהל המדעי של מכון אלה למלבאום לאימונואונקולוגיה ולמלנומה במרכז הרפואי שיבא, המרכז את הטיפול במרבית חולי המלנומה בישראל.
"היה ברור לנו שהשוואה בין דגימות מגרורות מלנומה שהוסרו בשלב טרום תחילת הטיפול, לבין כאלה מקבוצות חולים בהן הטיפול הצליח או נכשל, תהווה את המפתח לגילוי. החוכמה היא איזו השוואה לבצע", הוא מוסיף. במהלך המחקר בדקו החוקרים דגימות מלנומה מ-116 חולים, אשר הגיבו או לא הגיבו לאימונותרפיה. החוקרים נעזרו בשיטה חדשנית למיפוי חלבונים הקרויה פרוטאומיקה, וגילו שההבדל בין הקבוצות טמון בתהליכי הפקת האנרגיה של התאים הסרטניים.
"במעבדה לפרוטאומיקה אנו משתמשים במכשיר המכונה מס-ספקטרומטר, וממפים באמצעותו אלפי חלבונים," מסבירה פרופ' תמר גיגר, ראשת המעבדה לפרוטאומיקה בביה"ס לרפואה באוניברסיטת תל אביב. "לאחר מכן, אנו מבצעים אנליזה חישובית של הממצאים. בדרך זו ניתן לגלות בדיוק אילו חלבונים ואיזו כמות של חלבון מכל סוג מצויים בדגימה מסוימת".
בקרב קבוצת החולים שהגיבה לאימונותרפיה, התגלתה כמות גדולה יותר של חלבונים האחראיים על הפקת אנרגיה מחומצות שומן. "מצאנו שמסלול זה משפר את תהליך הזיהוי של תאי המלנומה על ידי מערכת החיסון, שכתוצאה מכך חושפת ותוקפת אותם בצורה יעילה", מסבירה פרופ' גיגר.

פרופ' גיגר - זיהתה את הקשר בין כמות החלבונים לזיהוי תאי מלנומה ע"י מערכת החיסון.
כדי לבדוק את ההשערה שלהם, השתמשו החוקרים בטכניקות של הנדסה גנטית, והשתיקו את פעילותם של החלבונים הקשורים בהפקת אנרגיה מחומצות שומן, בתרביות של תאי מלנומה. בעקבות זאת, נמצאה ירידה בהרג תאי מלנומה על ידי מערכת החיסון.
אותם ממצאים התגלו גם בבדיקה על עכברי מודל. "מצאנו שהשתקה של המנגנון מאפשרת לתאי הסרטן להסתתר מפני תאי T של מערכת החיסון, שאמורים לזהות אותם ולהשמידם, וכתוצאה מכך התפתח הסרטן בעכברים אלה בקצב מהיר יותר בהשוואה לקבוצת הביקורת", מסבירה פרופ' גיגר ומוסיפה: "במחקר זיהינו הבדל מנגנוני משמעותי בביולוגיה של תאי מלנומה בין חולים שחיים שנים בזכות טיפולי אימונותרפיה, לבין חולים שאינם מושפעים כלל מהטיפול".
"ממצאים אלו עשויים להיות נכונים גם במגוון מחלות ממאירות נוספות", מסכם פרופ' מרקל. "במחקרי המשך שנקיים, נבחן כיצד להיעזר בממצאים כדי לשפר את התגובה לאימונותרפיה ולהרחיב את מעגל החולים שיוכלו להפיק תועלת מהטיפולים. כמו כן, נפעל לפיתוח שיטה שתאפשר לצפות מראש במי מהחולים הטיפול יצליח או ייכשל".

יעלה את אחוזי ההצלחה בכמות מטופלים גדולה יותר. פרופ' מרקל במעבדה (צילום באדיבות המרכז הרפואי שיבא)

מחקר
חוקרים חשפו פגיעה במנגנוני הרבייה של אלמוגים במפרץ אילת, המסכנת את המשך קיומם

מנגנון הרבייה של האלמוגים הוא אחד מפלאי הטבע. מכיוון שאלמוגים אינם יכולים להתחיל לטייל בים ולחפש בני או בנות זוג להזדווג עימם, הם פיתחו דרך ייחודית וכמעט פלאית להתרבות. פעם בשנה, בליל ירח מלא של קיץ, משחררת כל שונית אלמוגים בתזמון מושלם מליוני תאי זרע וביציות. השחרור הסימולטני למים מעלה את הסיכויים שזרע וביצית יפגשו זה את זה, וכך ייווצר אלמוג חדש.
"אירועי הרבייה של האלמוגים היו לשם דבר בקרב חוקרים וחובבי טבע ימי, ואף כונו 'האורגיה הגדולה ביותר בעולם'", מספר הדוקטורנט תום שלזינגר, "מדובר באירוע קצר, בן דקות אחדות בלבד, שמתרחש רק פעם בשנה: אלפי אלמוגים לאורך מאות קילומטרים של שוניות, משחררים לים בו-זמנית כמויות עצומות של ביציות ותאי זרע, שמפרים אלו את אלו".
עוד לפני שהצלחנו להבין כיצד בדיוק מתרחש האירוע המופלא הזה, מסתבר שגם הוא בסכנה. חוקרים מאוניברסיטת תל אביב, בהובלת פרופ' יוסי לויה ותום שלזינגר מבית הספר לזואולוגיה, חשפו שיבוש של אירועי הרבייה של אלמוגים במפרץ אילת. הם מצאו כי חלק מהמינים כמעט ואינם מעמידים צאצאים.
החוקרים סבורים כי יתכן שהשיבוש נגרם על ידי שינויים בגורמים סביבתיים, כמו שינויי אקלים ו/או זיהומים שונים במים, ומביעים חשש כי לאורך זמן עלולה הפגיעה ברבייה להוות איום משמעותי על עצם קיומן של אוכלוסיות אלמוגים רבות ברחבי העולם. המחקר התפרסם בכתב העת היוקרתי Science, שאף הקדיש לו את כתבת השער.
התזמון המושלם של התרבות האלמוגים תלוי בסינכרון בין מספר גורמים סביבתיים, כגון טמפרטורת מי הים, עוצמת קרינת השמש, הרוח, מופע הירח ושעת שקיעת השמש, והשינויים העונתיים החלים בהם. מטרת המחקר היתה לבחון האם השינויים המהירים, המתרחשים כיום בסביבה הימית, משפיעים על הצלחת הרבייה, שבה תלוי עתידם של האלמוגים.

מראה מרהיב: מסיבת רביית אלמוגים שנתית. צילום: תום שלזינגר
בחלקו הראשון של המחקר, ערכו החוקרים סקרי-שטח ליליים בני 2.5 עד 5.5 שעות מדי לילה מתחת לפני הים, במהלך עונת הרבייה העיקרית של האלמוגים בין החודשים יוני עד ספטמבר, במשך ארבע שנים, מ-2015 עד 2018. כך הם עקבו אחר אירועי הרבייה של כל אחד ממיני האלמוגים בשטח, וספרו כמה פרטים מכל מין משתתפים באירוע בכל לילה, כלומר פולטים תאי זרע/ביציות למים.
"מצאנו שבמספר מינים השתבש סינכרון הרבייה לחלוטין," מעיד שלזינגר. "לפני מספר עשורים תועדו במפרץ אילת אירועי רבייה קצרים וממוקדים, שהתרחשו בלילות ספציפיים וקבועים בשנה. היום אותם אירועים נפרשים על פרקי זמן ממושכים, לפעמים עד חודשיים. כלומר, כמעט בכל לילה, מספר מועט של פרטים משחרר ביציות ותאי זרע. חלק מהמושבות פלטו את כל הזרעים והביציות, חלקן פלטו רק חלק, ואחרות לא השתתפו כלל באירוע".
כדי לספק מבט מעמיק יותר על התופעה, החליטו החוקרים לבחון אותה גם במעבדה. לשם כך הם אספו דגימות אלמוגים מאתרים שונים במפרץ אילת, בזמנים שונים לאורך עונת הרבייה, במהלך ארבע שנות המחקר.
הם בחנו את הדגימות על פי ארבעה מדדים: גודל הביציות המעיד על מידת בשלותן, מספר הביציות בכל פוליפ (פוליפ הינו יחידת הבניין הבסיסית הקטנה ביותר של מושבות האלמוגים), אחוז הפוליפים הפוריים בכל מושבת אלמוגים, ואחוז המושבות הפוריות באוכלוסייה כולה. "מצאנו שיבושים בסינכרון בכל המדדים ובכל הרמות: בפוליפ, במושבה ובאוכלוסיית האלמוגים כולה," אומר פרופ' לויה. "עדיין איננו יודעים מה בדיוק גורם לשיבושים, אך ייתכן שהם נגרמו על ידי שינויי אקלים, כדוגמת התחממות מי הים (מי מפרץ אילת מתחממים בקצב של כ-0.31 מעלות צלזיוס לעשור) או זיהומים שונים שיצר האדם".

בית גידול עשיר למינים רבים. אלמוגים במפרץ אילת (צילום: תום שלזינגר)
כדי לבחון את השפעת השיבוש בתיזמון על מידת הצלחת הרבייה ביצעו החוקרים מעקב אחר חלקות מסומנות בשונית הטבעית. בשנת 2015 הם מיפו את אלפי האלמוגים בחלקות אלו, ובשנים הבאות נעזרו בסקרים ובצילום ברזולוציה גבוהה, כדי לעקוב אחר השינויים במינים שונים של אלמוגים, ובדקו תמותה בהשוואה להתיישבות של אלמוגים צעירים חדשים.
"למראית עין מצבה הנוכחי של חברת האלמוגים במפרץ אילת הוא טוב, ובכל שנה מגויסים לשונית אלמוגים רבים חדשים", אומר שלזינגר "אך מצאנו הבדלים גדולים בין מינים שונים של אלמוגים. במינים בהם נצפה חוסר סינכרון באירועי הרבייה, התגלה גם חסר משמעותי בדורות חדשים של אלמוגים צעירים. למעשה, נראה שחלק מהמינים כלל אינם מצליחים להעמיד צאצאים כבר מספר שנים, דבר המעמיד בסכנה את עתיד המין כולו".
"המחקר שלנו מהווה קול קורא לחוקרי שוניות אלמוגים בכל העולם להמשיך ולחקור את התופעה שחשפנו במפרץ אילת, ולבדוק מהם הגורמים לשיבוש. מוטלת עלינו האחריות לזהות בדרך זו אוכלוסיות אלמוגים, אשר למראית עין הן בריאות ומשגשגות, אך למעשה ייתכן שהן על סף קריסה בשל היעדר דור המשך. עלינו לנקוט בכל הצעדים האפשריים, כדי למנוע את המשך הפגיעה הקשה בשוניות האלמוגים, המהוות בית גידול חיוני גם למינים רבים אחרים, ויוצרות את המגוון הביולוגי הגדול ביותר בסביבה הימית." מסכם פרופסור לויה.

מחקר
מודל החישוב ההנדסי שיעשה מהפך בתחום הטיפול בחולי לב

הלב שלנו הוא משאבה קשוחה וחזקה, שפועלת 24/7 כדי לווסת את זרימת הדם והחמצן לאיברי גופנו. ארבעה מסתמים מופקדים על הזרמת הדם במסלול חד כיווני - מהעלייה הימנית אל החדר הימני, משם ל"סיבוב הקטן" בריאות כדי לאסוף חמצן, בחזרה לעלייה השמאלית, למטה אל החדר השמאלי ומשם ברכבת הרים לכל רקמות גופנו.
מחלות לב וכלי דם הן גורם המוות המוביל בעולם המפותח, ומהוות כמעט 30% מכלל מקרי המוות מדי שנה. אך למרות זאת, תחום הרפואה עדיין לא יודע את כל מה שיש לדעת על האיבר המורכב הזה. ד"ר גיל מרום מבית הספר להנדסה מכנית בפקולטה להנדסה ע"ש איבי ואלדר פליישמן פיתח כלי, שיכול לייצר סימולציות ממחושבות, המאפשרות לזהות שינויים במבנה הרקמות של המסתמים בלב, וכך להבין טוב יותר את הביומכניקה של פעולת הלב, לזהות בעיות אצל חולים ולשפר את הטיפול בהם.
"המורכבות הפיזיקלית של מערכת הלב היא סיבה מרכזית לצורך בשימוש במודלים חישוביים, הנקראים גם סימולציות", מסביר ד"ר מרום. "פעולת שאיבת הדם בלב נגרמת על ידי התכווצות שריר הלב, כיוון זרימת הדם נקבע על ידי מסתמי הלב, בעוד התכווצות השריר נשלטת על ידי מערכת ההולכה החשמלית של הלב. סימולציות ממוחשבות מאפשרות לערוך ניסויים וירטואליים ולבחון אפשרויות שונות לטיפול באותו חולה".
בניגוד להשוואת מקרים ממספר חולים שונים, היכולת להשוות מקרים אצל אותו חולה מאפשרת ללמוד את ההשפעה של פרמטר מסוים על התפקוד, לבודד אותה מגורמים אחרים, וכך למצוא מגמות המאפיינות את הבעיה.
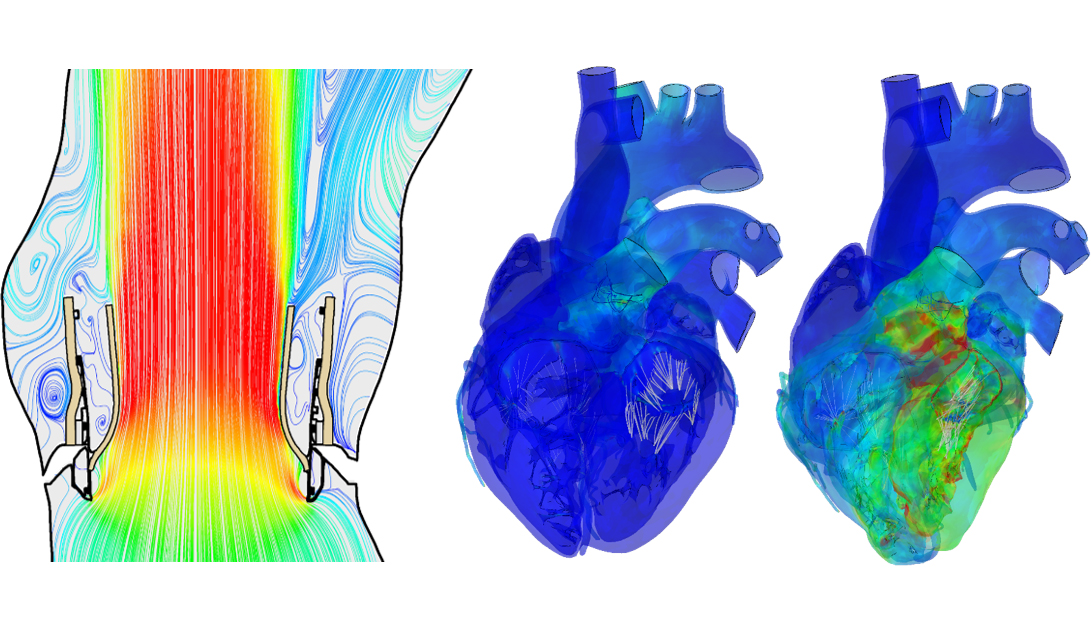
דוגמה למודלים של פעילות הלב במצב מכווץ ורפוי (צד ימין) ושל זרימת הדם דרך מסתם תותב (צד שמאל)
בנוסף להשלכות הרפואיות החשובות של המחקר, הוא מרתק גם מבחינה הנדסית. "שלא כמו במחקרים הנדסיים 'רגילים' בהם מאפייני הבעיה ידועים, במקרה של הגוף האנושי יש שונות גדולה במחלות ובאוכלוסייה", אומר ד"ר מרום. מהנדסים רבים מתכננים שסתומים ומשתמשים בהם, אבל ד"ר מרום טוען ששסתומי הלב הם סוג מיוחד של שסתומי-על: העלים הגמישים של מסתמי הלב צריכים לעבור עיוותים גדולים בכל מחזור לב (משך מחזור אחד הוא שנייה), לעמוד בלחצים גבוהים ביחס לחוזקם המכני, ובעצם לעבוד ללא הפסקה במשך הרבה מאוד זמן (כל חיינו).
לכן, אין זה מפתיע שחלק גדול ממחלות הלב המוכרות הן למעשה בעיות בשסתומי הלב. לבעיות הללו יש כבר טיפול - תיקונים או החלפת המסתם בניתוחי לב פתוח, ובשנים האחרונות נוספה גם אפשרות להשתלת מסתם בצנתור. אך עד כה היו צריכים רופאים לעבוד בשיטת ה"ננסה ונראה": על בסיס המידע הקיים מבצעים ניתוח או צנתור אחד בחולה.
"המודלים החישוביים שאנחנו מפתחים מאפשרים להבין טוב יותר את הביומכניקה של הטיפול, להעריך את הסיכויים לסיבוכים שונים ובעצם לבחון אופציות לטיפול עוד לפני המגע עם החולה", אומר ד"ר מרום ומסביר "לדוגמה, המודלים שלנו יכולים לעזור למנתחים לבחור את הקוטר הרצוי שאליו יש להקטין את קוטר המסתם החולה, על מנת להביא אותו לתפקוד תקין. גם במסתמים המושתלים בצנתור, לטיפול בהיצרות מסתם אבי העורקים, אנחנו יכולים על פי תוצאות הסימולציות להמליץ על גודל המסתם המתאים, מיקום ההשתלה האופטימלי ודרכי ההשתלה, כדי להפחית את הסיכוי לדליפות, תזוזה של המסתם המושתל בגלל התכווצות הלב, ופגיעה בהולכת החשמל בלב בגלל לחצי מגע, שהשתל מפעיל על הלב. אותן מסקנות יכולות לעזור גם בתכנון מסתמים תותבים חדשים, בעלי תפקוד טוב יותר וסיכוי מופחת להתפתחות הסיבוכים לאחר ההשתלה".
כעת מנסים ד"ר מרום וצוותו להבין את פעילות מנגנוני קרישת הדם על עלי מסתמים מושתלים, במטרה לתת מענה לחולים רבים, שכיום אינם מקבלים טיפול בגלל סיכון ניתוחי גבוה. "המטרה שלנו היא להבין במלואם את כל תפקודי הלב, כדי לשפר טיפולים קיימים ולפתח שתלים חדשים, שיצליחו לעמוד בעומסים המכניים הפועלים באיבר המורכב הזה, וכך לשפר את איכות חיי החולים", מסכם ד"ר מרום.