מחקר שנערך באוניברסיטת תל-אביב העלה כי תזונה מועשרת בשמן דגים משפרת את מצבם של פצעי לחץ ב-25-20 אחוזים


מחקר
מחקר שנערך באוניברסיטת תל-אביב העלה כי תזונה מועשרת בשמן דגים משפרת את מצבם של פצעי לחץ ב-25-20 אחוזים

שמן דגים הוא חומר עשיר בחומצות שומן מסוג אומגה 3 ובנוגדי חמצון, הידוע בסגולותיו הרפואיות. הוא יכול לסייע להורדת לחץ הדם, להקלת דלקות בעור ובמפרקים, ולהתפתחות תקינה של עוברים. פרופ' פייר זינגר מהפקולטה לרפואה באוניברסיטת תל-אביב ומהמחלקה לטיפול נמרץ כללי והמכון לחקר התזונה בביה"ח בילינסון, גילה כי לשמן דגים יש השפעה מיטיבה גם על פצעי לחץ. המחקר ותוצאותיו פורסמו בשני כתבי עת מדעיים: ,British Journal of Nutrition ו-American Journal of Critical Care.
פצעי לחץ הן כידוע בעיה מוכרת בקרב חולים במצב קשה. הם נגרמים כשהחולה נמצא בתנוחת שכיבה או ישיבה, ללא תנועה, לאורך זמן, והמשטח שמתחתיו יוצר לחץ ממושך על העור והרקמות. "פצעי הלחץ מכאיבים מאוד ומזדהמים בקלות, ולכן חשוב מאוד לרפא אותם", אומר פרופ' פייר זינגר. במחקר שלנו הוספנו שמן דגים כתוסף תזונה לחולים קשים, ובדקנו את השפעתו על פצעי הלחץ."
במסגרת המחקר, שנערך בשיתוף עם הדוקטורנטית מרים תהילה מהמרכז הרפואי ע"ש רבין, קיבלו החולים שמונה גרם של שמן דגים מדי יום במשך שלושה שבועות. והתוצאות היו חיוביות ביותר: שיפור של 25-20 אחוז על פי מדד הריפוי של פצעי לחץ, שהתבטא בירידה משמעותית בכאב ובאי-נוחות שנגרמו לחולים. בנוסף נצפו עלייה ביעילותה של מערכת החיסון והפחתת דלקות בכל הגוף.
חיזוק המערכת החיסונית
המחקר של פרופ' זינגר ועמיתיו התבסס על מחקר קודם, שהראה כי תוספי תזונה המכילים שמן דגים מעלים את רמות החמצן ברקמות של חולים קשים. הפעם ביקשו החוקרים לבחון אם התוספים יכולים גם לסייע בריפוי פצעי לחץ, הנגרמים בין היתר בשל חוסר חמצן, ירידה בזרימת הדם ורטיבות העור.
כדי לבחון את השערתם פיתחו החוקרים מחקר אקראי שכלל 40 חולים קשים. מחציתם המשיכו לקבל את התזונה הרגילה של בית החולים, והאחרים קיבלו בנוסף גם שמונה גרם של שמן דגים מדי יום. כעבור שלושה שבועות נצפה שיפור של 25-20 אחוז בהחלמת פצעי הלחץ אצל החולים שקיבלו שמן דגים, בהשוואה לקבוצת הבקרה.
בנוסף לשיפור בפצעי הלחץ, נהנו החולים שקיבלו שמן דגים מהתחזקות מערכת החיסון והפחתה בנפיחויות. "מצאנו שינוי בביטוי של קבוצת מולקולות הקשורה להכוונת תאי דם לבנים לעבר פצעים, דבר העשוי להסביר את השיפור בתהליך הריפוי", מסביר מפרופ' זינגר. בנוסף, כשבדקו את דמם של החולים, הבחינו החוקרים בירידה משמעותית בכמות של חלבון מגיבC , הקשור למגוון מצבים ומחלות: דלקות, זיהומים ויראליים ובקטריאליים, מחלות ראומטיות, פגיעה ברקמות ונקרוזה.
אמצעי טבעי לניהול כאב?
כעת מבקשים פרופ' זינגר ועמיתיו לבחון את השימוש בשמן דגים כשיטה טבעית לניהול כאב. במסגרת המחקר המתוכנן הם ימדדו את השפעתה של צריכת שמן דגים על עוצמת הכאב בקרב חולים לאחר ניתוח להחלפת הברך או מפרק הירך.

מחקר
חוקרים מאוניברסיטת תל-אביב מצאו: מעקב של 40 שנה חושף תועלת משמעותית מהפחתה בכמות הסיגריות

קיימים אינספור מחקרים המצביעים על התועלות העצומות שבהפסקת העישון: ירידה בסיכון למחלות שונות, הארכת תוחלת החיים ושיפור איכות החיים. אך אנשי מקצועות הבריאות מודים כי הדרך להפסקת העישון היא לעתים ארוכה וקשה, ורק אחוז קטן מהמעשנים מצליחים להגיע אל סופה.
"רופאים פוגשים מדי יום במטופלים שאינם יכולים או אינם רוצים להפסיק לעשן", אומרת ויקי מאיירס, חוקרת מבית הספר לבריאות הציבור בפקולטה לרפואה של אוניברסיטת תל-אביב. "כדי להתמודד עם המציאות בשטח בחרו מאיירס ועמיתיה, ד"ר יריב גרבר ופרופ' אורי גולדבורט, לבחון את רמות השרידות ותוחלת החיים של מעשנים שהפחיתו את מספר הסיגריות, אך לא חדלו לעשן. הנתונים שעמדו לרשות החוקרים כיסו תקופה ארוכה במיוחד של 40 שנה.
השיפור הגדול ביותר נמצא כצפוי אצל מעשנים שחדלו לחלוטין לעשן – ירידה של 22% בסיכון לתמותה מוקדמת בהשוואה למעשנים שלא שינו מהרגלם. עם זאת, גם מעשנים שרק הפחיתו את כמות הסיגריות, נהנו מירידה משמעותית של 15% בסיכון. ממצאים אלה מראים כי הפחתה בעישון מהווה בהחלט אסטרטגיה ראויה לצמצום סיכונים. מאיירס מציינת שהתועלת הגדולה ביותר מן ההפחתה נרשמה בקרב מעשנים כבדים.
המחקר מאוניברסיטת תל-אביב פורסם בכתב העת American Journal of Epidemiology.
מעשנים פחות ומאריכים את החיים
כדי לבחון את השפעת ההפחתה בעישון לאורך זמן הסתמכו החוקרים על נתונים מן המחקר הישראלי על מחלת לב איסכמית, שהחל בשנת 1963 והקיף 4,633 גברים – כולם עובדים ומעשנים באותה עת. המשתתפים, שגילם הממוצע היה אז 51 , רואיינו בנוגע להרגלי העישון שלהם בתחילת המחקר, ושוב כעבור שנתיים, ב-1965. אחר כך נערך מעקב אחר אחוזי התמותה בקרבם לאורך 40 שנה.
בראיון הראשון חולקו המשתתפים לארבע קטגוריות על פי מספר הסיגריות שעישנו ביום: 0, 10-1, 20-11, ו-21 ומעלה. בראיון השני ציינו החוקרים אם במהלך השנתיים שחלפו המרואיין הפחית, הגביר או שמר על רמת העישון, או הפסיק לעשן. הפחתה או הגברה הוגדרו כתזוזה בקטגוריה אחת או יותר.
באופן בלתי מפתיע התברר כי אלה שהפסיקו לעשן נהנו מהשיפור הגדול ביותר – ירידה של 22% בתמותה הכוללת. אצל מעשנים שהפחיתו את כמות העישון וירדו בקטגוריה אחת או יותר נמצאה ירידה של 15% בסיכון לתמותה בכלל, וירידה של 23% בסיכון למוות ממחלת לב. בנוסף מדדו החוקרים את שרידותם של משתתפי המחקר עד גיל 80. הם מצאו כי מי שחדל לעשן נהנה מסיכוי מוגדל ב-33% להגיע לגיל 80, ואילו אצל המפחיתים גדל הסיכוי ב-22%.
המחקר של הצוות מאוניברסיטת תל-אביב הוא מהבודדים שמתייחסים גם להפחתה בעישון, ולא רק להפסקה מוחלטת, ולדברי מאיירס ממצאיו מעידים באופן ברור כי עדיף להפחית מאשר לא לעשות דבר. "רבים מהמחקרים בוחנים שינויים לטווח קצר", היא אומרת, "אך כדי להוכיח את השפעתה החיובית של ההפחתה נדרש מעקב לאורך שנים רבות, מכיוון שהנזק שגורם העישון ותהליך ההחלמה ממנו אורכים זמן רב".
אף פעם לא מאוחר מדי
אחת המסקנות החשובות ביותר של המחקר היא שאף פעם לא מאוחר מדי לשנות את הרגלי העישון. משתתפי המחקר המקורי, שהיו בממוצע כבני 50 בתחילתו, יכלו עדיין להפסיק או לצמצם את העישון, וליהנות מתוצאות המאמץ לטווח הארוך. "אופציית ההפחתה שנויה במחלוקת, כי חלק מאנשי מקצועות הבריאות סבורים שהיא מחלישה את המסר שחייבים להפסיק לעשן. גם אנו ממליצים יותר מכל על הפסקת העישון, ועם זאת הוכחנו כי כאשר לא ניתן להפסיק, הפחתת העישון אף היא אסטרטגיה שמצמצמת סיכונים. לפיכך אנו ממליצים למעשנים לנקוט בכל צעד שהוא אפשרי מבחינתם, כדי לשפר את בריאותם לטווח הארוך," מסכמת מאיירס.

מחקר
בעקבות האוצר הימי: ד"ר נועה שנקר, ביולוגית ימית מאוניברסיטת תל-אביב, עומלת על מרשם מיליון המינים בסביבה הימית, עם קבוצת מדענים מ-32 מדינות

מוצאים את נמו
העשור האחרון היה העשור הפרודוקטיבי ביותר בתחום גילוי מינים חדשים למדע, ועם זאת עדיין ידועים רק כשליש מהמינים בסביבה הימית. על בסיס מאגר רישום המינים הימיים שייסד צוות מומחים בינלאומי, הוכנה לראשונה רשימה של כל המינים הידועים כיום בסביבה הימית ובוצעה הערכה לגבי מספר המינים שעוד לא נתגלו. ממצאי המחקר יוכלו לסייע במאמצים לשימור מינים ולהערכת סכנת ההכחדה המאיימת עליהם. הממצאים המלאים של הפרויקט המחקרי המכונה "מרשם המינים הימיים העולמי", פורסמו בכתב העת "Current Biology".
ד"ר נועה שנקר מהמחלקה לזואולוגיה באוניברסיטת תל-אביב, לקחה חלק בקבוצת המרשם שהתמקדה במינים ממחלקת האצטלנים – בעלי חיים חסרי חוליות, וריכזה את המידע הנוגע לים סוף ומזרח הים התיכון. במחקריה הטקסונומיים תיארה ד"ר שנקר שלושה מינים שלא היו מוכרים למדע. כנהוג, זכו המינים לשמות פרי מחשבתה, אחת הפריבילגיות שמגיעות עם התפקיד. לאחד מהם קראה רופלאה עידונטע, שילוב של שמות ילדיה - עידו ונטע, ואילו למין אחר קראה בולטיניה יוסי לויה, על שמו של פרופ' יוסי לויה, ראש מעבדה לביולוגיה ימית באוניברסיטת תל-אביב.
מחקר על רטוב
למרות הדימוי הרווח של טקסונומים כחוקרים המעבירים את ימיהם סגורים במעבדה ומוקפים בצנצנות מלאות בפורמלין, מדובר, לדברי ד"ר שנקר, בתחום מחקר אטרקטיבי מאוד, הכולל הרבה עבודת שטח. בתחום הביולוגיה הימית מדובר כמובן בצלילות, המאפשרות להגיע לעומק רב ולאתר מינים חדשים.
20,000 מינים חדשים מתחת למים
מתוצאות מרשם המינים עולה כי ידועים כיום כ-226,000 מינים בסביבה הימית. בעשור האחרון התגלו כ-20,000 מינים חדשים, יותר מינים מאשר בכל עשור אחר. כמו כן מספר החוקרים העוסקים בתיאור מינים חדשים עלה בצורה משמעותית ב-60 שנים האחרונות. עוד עולה מן המחקר, כי בממוצע כ-37% מהמינים בלמעלה ממאה איסופי שדה מרחבי העולם, הם מינים חדשים למדע.
בין 58,000 ל- 72,000 מינים חדשים התגלו אך טרם תוארו, ובין 482,000 ל-741,000 מינים חדשים עוד אמורים להתגלות. שיטות מולקלוריות יכולות להוסיף עוד אלפי מינים קריפטים (מינים זהים מורפולוגית אך שונים מבחינה מולקולרית).
המסקנה העיקרית שעלתה מן המחקר היא כי בין שליש לשני שליש מהמינים בסביבה הימית עדיין לא תוארו, וההערכה היא שקיימים בין 0.7 ל-1 מיליון מינים בסביבה הימית. אם מגמת העלייה של גילוי המינים תמשיך, ההערכה של צוות המומחים היא שעד לסוף המאה מרבית המינים בסביבה הימית יתגלו.
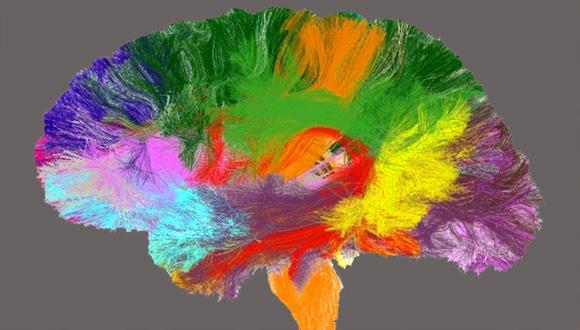
מחקר
חוקרים מאוניברסיטת תל-אביב הובילו את הפרויקט הבינלאומי העשוי לשנות את מפת המחקר והרפואה בתחום המוח

בשיתוף מוחות
חוקרים מאוניברסיטת תל-אביב הובילו פרויקט מחקר אירופי רחב היקף שכלל 12 קבוצות חוקרים, שבנו לראשונה אטלס מלא של מיקרו-מבנים בחומר הלבן של המוח האנושי. הפרויקט, שעשוי לשנות בשנים הבאות את מפת המחקר והרפואה בתחום המוח, הסתמך על טכנולוגיית ה-MRI, וזכה לתמיכה של 2.5 מיליון יורו מהאיחוד האירופי, בקטגוריית 'טכנולוגיות העתיד'. השותפים במחקר - שכונה CONNECT – פועלים במרכזי מחקר מובילים בישראל, אנגליה, גרמניה, צרפת, דנמרק, שוויצריה ואיטליה. ביום שישי, 19.10.12, בתום שלוש שנות מחקר, הם עתידים להתכנס בפריס ולהכריז על סיומו המוצלח של הפרויקט.
מוח האדם בתלת מימד
"היום נעזרים צוותים רפואיים וקבוצות מחקר באטלס ישן של המוח, המתבסס על מוחו של אדם אחד, אשר תרם את גופו למדע." מסביר פרופ' יניב אסף מהמחלקה לנוירוביולוגיה באוניברסיטת תל-אביב ומבית הספר סגול למדעי המוח, שיזם את המחקר הבינלאומי ושימש כמתאם קבוצות המחקר, "האטלס החדש, לעומת זאת, מבוסס על דגימות MRI של נבדקים רבים, ואף מוגש בתלת מימד. לפיכך, בזכות שיטת המחקר והיקפו, הוא מפורט ומדויק הרבה יותר. למעשה, האטלס החדש מאפשר לנו לבחון את המוח בדרך שהייתה אפשרית קודם רק במיקרוסקופ".
החידוש הראשון באטלס טמון בעצם מיפויו של החומר הלבן - המורכב מסיבי עצב המעבירים מידע - במוחם של אנשים חיים, ולא בנתיחה שלאחר המוות. פריצת הדרך התאפשרה בזכות טכנולוגייתMRI , שמסוגלת ליצור תמונה של המוח החי בהליך בלתי חודרני. שנית, האטלס החדש אינו מסתפק במידע ממוח אחד, אלא מסתמך על הדמיית מוחותיהם של 120 נבדקים בריאים, בני 35-25 שנים. הנתונים, שקובצו ועובדו בטכניקות עיבוד תמונה מתקדמות, נותנים תמונה רחבה ומדויקת של מבנה המוח התקין.
האטלס החדש מציג מיקרו-מבנים זעירים בכל רחבי המוח באופן מסודר ומקודד, המתאים גם למשתמש שאינו מומחה בחקר המוח, כגון רופא או חוקר מתחום אחר. התמונות מייצגות פרמטרים מגוונים, שנאספו ונמדדו באמצעות ה-MRI, כמו למשל עובי הסיבים וצפיפותם באזורים השונים. הן נועדו לשמש סטנדרט של מוח בריא, שאליו ניתן להשוות הדמיות ממוחות של מטופלים ונבדקים עתידיים.
מהחומר האפור לחומר הלבן
בנוסף לתרומתו הרפואית, צפוי הפרויקט להאיץ ולקדם באופן משמעותי את חקר החומר הלבן במוח, פעילותו ותפקודיו. "עד היום התמקדו מדעני המוח בעיקר במה שמכונה 'החומר האפור'," אומר פרופ' אסף. "הם נמנעו מלחקור את 'החומר הלבן', המהווה כמחצית מנפח המוח, בעיקר מפני שחסרו להם שיטות מחקר יעילות. שיטת ה-MRI שפיתחנו תאפשר לחוקרים לראשונה להתבונן במתרחש בסיבי העצב במוח החי, ותפתח בפניהם עולם של אפשרויות חדשות".
בין היתר מתכוונים פרופ' אסף ועמיתיו להיעזר בטכנולוגיה כדי לבחון את הדינמיות וההשתנות לאורך זמן של המיקרו-מבנים שבחומר הלבן. כך לדוגמה, הם יחפשו את טביעת האצבע שמותיר תהליך קוגניטיבי, כמו למידת נושא חדש, בסיבים שבמוח. כיוון מחקר נוסף הוא אפיון והבנת השינויים שגורמות מחלות שונות במוח האנושי, כמו אלצהיימר או סכיזופרניה, במטרה לפתח שיטות אבחון יעילות ואמינות.

מחקר
מחקר חדש שופך אור על הדמיון בין התקשורת החברתית של חיידקים לזו של תאים סרטניים ומציע כיווני מחקר חדשים למאבק בסרטן

הפייסבוק של החיידקים ושל תאי הסרטן
במעבדתו של פרופ' אשל בן-יעקב מבית הספר לפיזיקה ולאסטרונומיה בפקולטה למדעים מדויקים ע"ש ריימונד ובברלי סאקלר חוקרים את התנהגותם החברתית של חיידקים. אולם, לא רק החיידקים חולקים ביניהם תקשורת חברתית ענפה. "כמו החיידקים, גם תאי סרטן מסתמכים על תקשורת ועל שיתוף פעולה", טוען פרופ' בן-יעקב.
שיתוף פעולה בין חוקרי מעבדתו של פרופ' בן-יעקב ובין החוקרים האמריקאיים פרופ' דונלד קופי, חוקר סרטן מאוניברסיטת ג'ונס הופקינס, ופרופ' הרברט לוין מאוניברסיטת רייס, העלה תוצאות מעניינות אודות התנהגותם החברתית של תאי סרטן. המחקר מצביע על דמיון בין מנגנון התקשורת החברתית של חיידקים לבין מנגנון התקשורת שחולקים תאים סרטניים בגופם של חולים. המודל שמוצג במחקר מתאר שיתוף פעולה בין תאי סרטן המאותתים זה לזה על אזורים בהם ניתן להתיישב ולפתח גרורות סרטניות. תוצאות המחקר התפרסמו בכתב העת המדעי Trends in Microbiology.
ריגול ומודיעין
תאים בריאים בגוף מתנהגים בהתאם לאותות ולהוראות הכימיים והפיזיקליים שהגוף שולח. לעומתם, חיידקים ותאים סרטניים מצליחים להתרבות על ידי עקיפה של מערכת החיסון ושיגור מסרים לשיבוש פעילותה. בכדי להשיג יעדים אלו, משתמשים תאי הסרטן באינטראקציות מורכבות על מנת לחלוק משאבים ולחלק משימות באופן יעיל בינם לבין עצמם.
"לפני שתאים סרטניים מתפשטים בגוף ויוצרים גרורות, הם שולחים לכל חלקי הגוף נציגים המתפקדים כ'תאי ריגול' ומנווטים את תאי הסרטן במקור הגידול אל האזורים בהם ניתן להתיישב ולפתח גרורות", מתאר פרופ' בן-יעקב. רק לאחר השלמת תהליך זה, עוזבות הגרורות את מקור הגידול הסרטני ומתפשטות בגוף. בנוסף, יש ביכולתם של תאים סרטניים לשנות את סביבתם ולהכריח תאים בריאים לספק להם תמיכה והגנה באמצעות שינויים גנטיים, בדומה לחיידקים.
לבלבל את האויב
לדברי פרופ' בן-יעקב, חקר התנהגותם החברתית של תאי סרטן יכול להוביל לכיווני מחקר חדשים ולדרכים חדשות להתמודד עם המחלה, לדוגמא, פיתוח סוג חדש של תרופות נגד סרטן אשר משבשות את התקשורת בין התאים ושולחות מסרים שגויים על מנת להאט או לעצור את התפשטות המחלה.
בין היתר, חקר פרופ' בן-יעקב בעבר את תופעת הקניבליזם בקרב מושבות חיידקים ופיצח את הקוד התקשורתי שהוביל את החיידקים להרוג זה את זה. בן-יעקב מציע לבחון את תופעת ה"קניבליזם" גם בקרב תאי הסרטן. תאים לעיתים טורפים אחד את השני כאשר משאביהם נגמרים. בעזרת האותות הנכונים יתכן כי חוקרים יוכלו להורות לתאי סרטן לתקוף ולחסל האחד את השני.
הצעה נוספת שהעלה צוות המחקר קשורה ביכולתם של תאי סרטן להיכנס ל"תרדמת" כאשר החולה עובר כימותרפיה ולהתעורר שוב לאחר סיום הטיפול. על פי פרופ' לוין ייתכן כי היכולת לפענח את אמצעי התקשורת בין תאים סרטניים תאפשר לרופאים "לעורר" את אותם תאים רדומים ולהורגם על ידי שליחת מסרים מתאימים. מסרים אלו יכולים להישלח באמצעות חיידקים.
חוקרים אחרים כבר הדגימו בעבר כי חיידקים מוזרקים הצליחו "להערים" על תאי סרטן ו"ללמד" את מערכת החיסון לזהות את התאים הסרטניים ולחסלם. "יתכן ואנו נכנסים לעידן חדש של ‘מלחמה סייבר ביולוגית' בסרטן שבה מדענים יכולים לרתום את האינטליגנציה של החיידקים על מנת להביס תאים סרטניים", מסכם פרופ' בן-יעקב.

מחקר
משלחת החפירות של החוג לארכיאולוגיה באוניברסיטת תל-אביב מצאה במבצר אפולוניה את אחד מאוצרות הזהב הגדולים שנמצאו בארץ

לפני כשבועיים, נמצא במבצר הצלבני באפולוניה מטמון זהב מהגדולים שנמצאו אי פעם בישראל, על ידי משלחת החפירות המשותפת של אוניברסיטת תל-אביב ורשות הטבע והגנים. את האוצר איתר מתי יוחננוף, סטודנט בחוג לארכיאולוגיה באוניברסיטת תל-אביב, בתוך כלי חרס שבור, תחת מרצפות אחד החדרים שבמבצר.
החפירות הארכיאולוגיות באפולוניה, סמוך להרצליה, התחדשו לפני כשלוש שנים, במסגרת המאמצים למנוע את קריסת המצוק שעליו מצויים שרידי העיר הצלבנית. החפירות שופכות אור על ימיהם האחרונים של העיר ושל המבצר, שהיה אחד המאחזים הצלבניים החשובים בארץ באותה התקופה.
הערכה ראשונית: שווי המטמון כמאה אלף דולר
משקל הזהב במטמון מגיע ל-400 גרם ומכיל בין היתר 108 מטבעות זהב בערך של דינר. לדברי ראש משלחת החפירות, פרופ' אורן טל, מהחוג לארכיאולוגיה באוניברסיטת תל-אביב, בתקופה ההיא, 2 דינר הספיקו לכלכלת משפחה למשך שנה שלמה, מה שמצביע על ערכו הגבוה של המטמון יחסית לתקופה. הערכה ראשונית של שווי האוצר בימינו מדברת על יותר ממאה אלף דולר, אך טרם ניתן לקבוע זאת בביטחון.
פרופ' טל מעריך כי האוצר במקום קשור באירועים הדרמטיים שהתרחשו במבצר במארס-אפריל, בשנת 1265, עת הותקפה העיר על ידי צבאו של הסולטן בייברס הממלוכי, ונפלה לאחר 40 ימי מצור. להערכת החוקרים, יתכן והמטמון היה שייך לאחד המפקדים הצלבנים שהחליט לקבור ולהחביא את קופתו המרכזית מפני הכובשים המוסלמים.
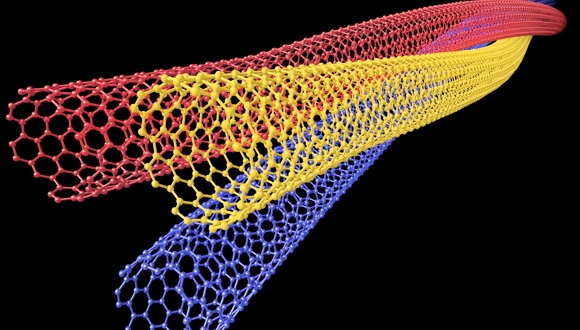
מחקר
בפרויקט לאומי רחב היקף בראשות פרופ' דן פאר עומלים על פיתוח מערכות ננומטריות להובלת תרופות חכמות בתוך 5 שנים

מערכות ננומטריות להובלת תרופות
פרופ' דן פאר מהמחלקה לחקר התא ולאימונולוגיה באוניברסיטת תל-אביב מוביל מאמץ מחקרי מסוג חדש, במטרה לפתח מערכות ננומטריות להובלת תרופות, שייתנו מענה למגוון רחב של מחלות. הפרויקט, המקיף 11 מעבדות, בהיקף של 11.5 מיליון דולר, יבנה תשתית טכנולוגית, שתהיה זמינה למסחור וליישום תעשייתי כבר בעוד חמש שנים.
"הפרויקט שלנו הושק ב-2012, והוא מהווה מאמץ מחקרי ממוקד מסוג חדש, שלא היה כמותו בישראל עד היום", אומר פרופ' פאר. "מטרתנו היא לבסס תשתית טכנולוגית חדשה בתחום הננו-רפואה, שתהיה זמינה למסחור וליישום תעשייתי כבר בעוד חמש שנים – תקופה קצרה מאוד במונחים של מחקר מדעי. לשם כך בחרנו 11 צוותי מחקר (מהם שמונה באוניברסיטת תל-אביב), המפתחים קשת רחבה של אסטרטגיות בתחום מתקדם ומרתק: חלקיקים זעירים שמובילים תרופות ואמצעי הדמיה ישירות ליעדם בתוך גוף האדם. העבודה שלנו מעוררת כבר היום התעניינות רבה בקרב חברות גדולות לתרופות".
ננו-רפואה בטווח רחב
הקבוצות המשתתפות בפרויקט החדשני מתמחות במגוון תחומים: סינתזה כימית ופולימרים, הנדסת נוגדנים, מערכת החיסון, שימוש בחלקיקים ממקור ביולוגי, ביולוגיה תאית, הדמיה וקרדיולוגיה. מחקריהן עוסקים בטווח רחב של מחלות, בעיקר מחלות הכרוכות בחוסר או בעודף כלי דם, ובמחלות הקשורות למערכת החיסון - כמו סוגים שונים של גידולים סרטניים וסרטן הדם, התקפי לב, תהליכים דלקתיים ומחלות נגיפיות שתוקפות את מערכת החיסון, כגון איידס. הפרויקט זוכה לתמיכה משמעותית מממשלת ישראל, במסגרת יוזמה לאומית ישראלית לננוטכנולגיה, שמטרתה להקים ולקדם מרכזי ננו במוסדות מחקר ישראליים - Israel National Nanotechnology Initiative.
שותפיו לפרויקט של פרופ' פאר באוניברסיטת תל-אביב הם: פרופ' אהוד גזית מהפקולטה למדעי החיים, כיום המדען הראשי של משרד המדע, פרופ' איתי בנהר ופרופ' רמונה מרגלית מהפקולטה למדעי החיים, פרופ' דורון שבת ופרופ' משה פורטנוי מבית הספר לכימיה, פרופ' רונית סצ'י-פאינרו מבית הספר לרפואה ופרופ' יונתן ליאור מהפקולטה לרפואה ומהמרכז הרפואי שיבא. בנוסף, שותפות בפרויקט ד"ר גליה בלום מבית הספר לרפואה בהדסה עין כרם, ד"ר איילת דוד מבית הספר לרפואה באוניברסיטת בן גוריון ופרופ' שולמית מיכאלי מאוניברסיטת בר-אילן.
הובלת תרופות אל דלקות במעי
תחת הגג הכולל של הפרויקט הננו-רפואי, מתמקדת קבוצת המחקר של ד"ר פאר בתחום של מחלות דלקתיות של המעי, כמו קרוהן וקוליטיס. במעבדתו פועל צוות רב-תחומי המונה 18 חוקרים – מהנדסים, ביוטכנולוגים, פיזיקאים, ביולוגים, כימאים וּוטרינרית, ומשתף פעולה עם רופאים וכירורגים רבים במרכזים הרפואיים שיבא, רבין ואיכילוב, ועם המרכז הגדול למחלות מעי שבאוניברסיטת קלגרי בקנדה.
"בהיבט הטכנולוגי אנו מפתחים אסטרטגיה להובלת תרופות ואמצעי אבחון ננומטריים אל דלקות במעי", מסביר ד"ר פאר. "הטכנולוגיה שלנו מתבססת על חלקיקים בקוטר ננומטרי המצופים בנוגדנים. הנוגדנים הללו מכירים תאים ממערכת החיסון המצויים בזרם הדם, ש'נקראים, אל האזור הנגוע בגוף, ומתבייתים עליו. תאים כאלה יכולים, על-פי תפיסתנו, לשמש כמערכות ניווט, מעין GPS, שינחו את החלקיקים הננומטריים ישירות אל היעד. על סמך גישה זו אף פיתחנו שיטה לאבחון מחלות מעי דלקתיות, שאינה פולשנית כמו הטכניקות המקובלות של קולונוסקופיה וגסטרוסקופיה: הזרקנו למחזור הדם של חיות מעבדה חלקיקים ננומטריים מסומנים, שהתבייתו על תאי מערכת החיסון שבדם, 'נסעו' איתם אל התאים החולים במעי, וסימנו אותם עבור מערכות ההדמיה. בשימוש מורחב יכולים חלקיקים כאלה גם לשאת ולשחרר תרופות".
משלבים טכנולוגיה עם ביולוגיה
כדי למלא טווח רחב של משימות, מפתחים ד"ר פאר וצוותו נשאים ננומטריים במגוון גדלים וסוגים, המותאמים למחלות ולמטלות שונות. כל הנשאים המיוצרים במעבדה מבוססים על שילובים של חומרים ביולוגיים – שומנים, סוכרים וחלבונים. כך, לדוגמה, גילו החוקרים כי השומנים כולאים בתוכם ביעילות תרופות ואמצעי הדמיה, בעוד שציפוי של סוכרים מונע הידבקות של החלקיקים זה לזה. החלבונים הם בעיקר נוגדנים וליגנדים, שמתחברים אל פני השטח של החלקיקים, מנווטים אותם אל תאי היעד, וגם מסייעים להם לחדור לתוכם.
אך ד"ר פאר אינו מסתפק בפיתוח של נשאי תרופות חכמים. "קבוצות מחקר רבות בכל העולם מפתחות היום נשאי תרופות ננומטריים מסוגים ומחומרים שונים", הוא אומר. "הייחוד במעבדה שלי הוא שאנו משלבים טכנולוגיה עם ביולוגיה. יש לנו צוות ביולוגי ייעודי, שמחפש גם את התרופות עצמן, והשילוב הזה מעניק למחקר שלנו עוצמה מיוחדת".

מחקר
במעבדה למיקרוארכיאולוגיה השוואתית באוניברסיטת תל-אביב בודקים את ההרכב הכימי של תעודות קדומות על-מנת לאתר את מקורן הגיאוגרפי וההיסטורי

תעודות בעידן בינלאומי קדום
בראשית האלף השני לפנה"ס החל תהליך גיבושן של המעצמות הגדולות של העולם העתיק, ובהן מצרים, בבל, אשור, מיתַנִי וחַתִּי. תהליך זה היה כרוך בעימותים צבאיים רבים שהובילו בסופו של דבר לכינון יחסי שלום בין המעצמות ולתחילתו של שלב המכונה בפי חוקרים מודרניים "העידן הבינלאומי". עידן זה נמשך כמאתיים שנה ובמהלכו נכרתו חוזים בין המעצמות שלוו בקשרים דיפלומטיים מסועפים. יחסים אלה באו לידי ביטוי בתעודות שהתגלו בארכיונים של המעצמות (בבל, אשור, חתי ומצרים), וכן בארכיון התעודות העשיר שהתגלה באוגרית, עיר כנענית קדומה.
במהלך למעלה ממאה שנים של מחקר אינטנסיבי פורסמו רבות מן התעודות שנמצאו בארכיונים של המזרח הקדום. תעודות אלה סיפקו מידע רב, אך גם עוררו שאלות בנוגע למקורותיהם של הטקסטים ותנועותיהם במרחב. שאלות אלו היו מקור לוויכוחים ולדיונים, שדומה כי במקרים רבים הגיעו למבוי סתום.
בניסיון להשיב על אותן שאלות, פותחה לפני כעשר שנים על ידי פרופ' יובל גורן, ראש המעבדה למיקרוארכיאולוגיה השוואתית שבאוניברסיטת תל-אביב, גישה מחקרית חדשה הבוחנת את תעודות החומר הכתובות בכתב היתדות מכיוון שונה לחלוטין מזה שהיה מקובל עד כה. לשם קביעת מוצאן נרתמו שיטות מחקר מתחומי מדעי הטבע והמדעים המדויקים, שיש ביכולתן לענות על מגוון רחב של שאלות הקשורות למקורן ולדרכי תפוצתן של התעודות.
צוהר אל הגיאוגרפיה של התקופה
חומר הכתיבה שעליו הוטבעו הסימנים בכתב היתדות הוא החומר (clay), המכיל חרסיות וחומרים מלכדים (חסמים), שנאספו על-ידי הסופרים ונלושו לשם יצירת המצע לכתיבה. כדי לקבוע את מקום מוצאו של החומר ניתן ליישם מגוון של שיטות מינרלוגיות וגאוכימיות, שמשמשות מזה מספר עשורים במחקרים על המוצא והטכנולוגיה של כלי חרס. שיטות אלה בוחנות את הרכב המינרלים והיסודות הכימיים של החרסיות והחסמים שבחומר ומעמתות אותם עם בסיסי נתונים גיאולוגיים. בדרך זו אפשר לעמוד במקרים רבים על מקורן של התעודות ועל התהליכים הטכנולוגיים ששימשו ביצירתן.
בשיטה זו אפשר אף לאתר את הסוג והמקור של התצורות הגיאולוגיות שמהן נגזרו מרכיבי הטין (משקע בעל גרגירים זעירים הנפוץ באזורים מדבריים), וכך לקבוע את מוצאן הגיאוגרפי של התעודות, שאינו זהה תמיד למקום שבו התגלו בחפירות. שילוב הנתונים הללו עם המידע המתקבל מן הטקסטים עצמם פותח בפני המחקר צוהר נוסף אל הגיאוגרפיה וההיסטוריה בתקופה זו.
הרכב המינרלים שבחומר
המתודה המחקרית המבוססת על יישום שיטות אנליטיות מינרלוגיות-פטרוגרפיות על ממצאים ארכיאולוגיים מחומר, בעיקר על כלי חרס, החלה את צעדיה הראשונים עוד במחצית הראשונה של המאה העשרים. פטרוגרפיה היא שיטת מחקר גאולוגית הבוחנת את הרכב המינרלים שבחומר (במקור בסלעים) באמצעות בדיקתם בשקפים תחת מיקרוסקופ אופטי המצויד בעזרים שונים בהם מערכת מסננים מקטבים, החוסמים את קרני האור לפי תכונת הקוטביות שלהן (הקשרים האלקטרומגנטיים בין האטומים בחומר). שיטה זו מאפשרת את זיהויין של פאזות גבישיות שונות בתוך החומר (שלבים שונים בתהליך הגעתו של החומר למצב צבירה מוצק).
כיום משמשות הבדיקות הפטרוגרפיות ככלי פשוט יחסית, מהיר, זול ורב-ערך בחקר הטכנולוגיה הקדומה ובחקר ההרכב והמוצא של כלי חרס, אבן ומוצרי טיח ארכאולוגיים. בדרך זו נחקר (בשיתוף עם הפרופסורים נדב נאמן וישראל פינקלשטיין) מוצאן של התעודות מארכיון אל עמרנה שהתגלה במצרים, ובשיתוף עם ד"ר יורם כהן ותלמידתם מיטל קאופמן, נחקרו תעודות מן הארכיון שהתגלה באוגרית.
מכשיר ספקטרו-פוטומטר XRF נייד
הקושי העיקרי בכל השיטות הללו נעוץ בצורך להסיר דוגמאות מן החומר לבדיקה. אמנם פיתוחן של שיטות דגימה מיוחדות לצורך הבדיקות הפטרוגרפיות על-ידי פרופ' יובל גורן לפני כעשור, צמצם מאוד את מידת הפגיעה בתעודות, אך עצם היותה של הבדיקה פולשנית גרם לא פעם לקשיים בקבלת אישור למחקר מצד אוצרי מוזיאונים ומנהליהם.
מתוך מטרה למצוא פתרון לבעיה זו, נרכש בסיוע סגן הנשיא למחקר של אוניברסיטת תל-אביב, מכשיר נייד מסוג X-Ray Fluorescence) XRF) בעל גלאי חדיש מסוג silicon drift, המגלה עד 34 יסודות כימיים ברמת דיוק גבוהה, וברוב המקרים ללא צורך בהסרת דגימה. במהלך השנתיים האחרונות פותחה במעבדה למיקרוארכאולוגיה השוואתית מתודה לשימוש במכשיר זה לצורך אפיון מוצאן של תעודות החומר על פי הרכבן הכימי.
המכשיר, שדומה בגודלו ובצורתו למייבש שיער רגיל, ניתן להובלה במטוס במטען יד, ומאפשר לבצע אנליזות בלתי-פולשניות של ההרכב הכימי של התעודות באולמות התצוגה או האחסון של המוזיאונים, תוך עיבוד מיידי של הנתונים לקביעת מוצאן, והשוואתם לבסיסי נתונים הנשענים על תעודות מן המזרח הקדום, שמוצאן נבדק בשיטות האנליטיות הקודמות וגם בשיטה זו.
במהלך השנה האחרונה התבצע מחקר ראשון מסוג זה על התעודות מחַתּוּשָה (כיום בּוֹעֲ'זְקּוֹי), בירת האימפריה החיתית, השמורות במוזיאון הלאומי בברלין, ותעודות מאל עמרנה שבמצרים השמורות בברלין ובמוזיאון הבריטי בלונדון. פרסום ראשון בנושא הופיע בכתב העת Journal of Archaeological Science. המחקר נעשה על-ידי פרופ' יובל גורן ופרופ' יורג קלינגר (מן האוניברסיטה החופשית בברלין) בתמיכת הקרן הדו-לאומית ישראל - גרמניה.