מחקר ראשון מסוגו מראה כי טיפול חדשני בתא לחץ עשוי לשפר את תפקודם הקוגניטיבי של אנשים בריאים בגיל המבוגר

מחקר
מחקר ראשון מסוגו מראה כי טיפול חדשני בתא לחץ עשוי לשפר את תפקודם הקוגניטיבי של אנשים בריאים בגיל המבוגר

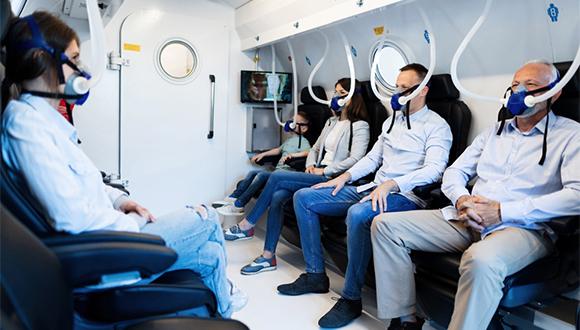
הרפואה ההיפרברית, שמציעה טיפולי חמצן בלחץ גבוה באמצעות תא לחץ למגוון רחב של בעיות רפואיות, מלווה אותנו כבר לא מעט שנים. כעת, מחקר ראשון מסוגו של הפקולטה לרפואה ע"ש סאקלר וביה"ס סגול למדעי המוח בשיתוף מרכז סגול לרפואה היפרברית ומחקר במרכז הרפואי שמיר (אסף הרופא), חושף לראשונה כי טיפול בבני אדם בתא לחץ באמצעות חמצן נקי בלחץ גבוה, יכול לשפר משמעותית את תפקודם הקוגניטיבי של אנשים בריאים בגיל המבוגר. התחומים העיקריים בהם ניכר השיפור הינם קשב, מהירות עיבוד מידע, תפקודים ניהוליים וכן תפקוד קוגניטיבי כולל, שנחלשים כחלק מתהליך ההזדקנות הנורמלי. כמו כן, נצפה מתאם משמעותי בין שינויים קוגניטיביים לבין שיפור בזרימת הדם במקומות במוח האחראים על תפקודים אלו.
המחקר נערך על ידי פרופ' שי אפרתי, ראש מרכז סגול לרפואה היפרברית ומחקר, ראש מערך המחקר במרכז הרפואי שמיר (אסף הרופא), וחבר סגל בפקולטה לרפואה ע"ש סאקלר וביה"ס סגול למדעי המוח באוניברסיטת תל אביב, וד"ר אמיר הדני ממרכז סגול לרפואה היפרברית ומחקר, מרכז רפואי שמיר (אסף הרופא), והוא פורסם בכתב העת המדעי Aging.
פרופ' שי אפרתי וד"ר אמיר הדני תכננו את המחקר על סמך פרוטוקול ייחודי לטיפול בתא לחץ, שפותח במרכז סגול במהלך העשור האחרון. 63 אנשים בריאים מעל גיל 64 השתתפו במחקר קליני מבוקר-הקצאה-אקראית. 33 מהם עברו טיפול בתא לחץ לאורך שלושה חודשים, ו-30 שימשו כקבוצת ביקורת.
תפקודם הקוגניטיבי של כל המשתתפים נמדד באמצעות סוללה אחידה, מקיפה וממוחשבת של הערכות קוגניטיביות - לפני ואחרי תקופת ההתערבות. הערכת זרימת הדם במוח בוצעה באמצעות טכניקת MRI חדשנית לבדיקת מעבר דם בכלי הדם הקטנים במוח (זילוח).
"ירידה קוגניטיבית ותפקודית כתוצאה מעלייה בגיל הפכה לבעיה משמעותית בעולם המערבי. מאמצי מחקר נרחבים בכל העולם מתמקדים בשיפור ביצועים קוגניטיביים בקרב האוכלוסייה המזדקנת 'הנורמלית'," אומר פרופ' אפרתי. "במחקר שלנו, שנערך לראשונה בבני אדם, גילינו התערבות רפואית בטוחה ואפקטיבית שיכולה לתת מענה לתוצאותיה הבלתי רצויות של הירידה התפקודית, הצפויה כתוצאה מהליך הזדקנות נורמלית."
"במהלך שנים של מחקר פיתחנו וקידמנו הבנה של פרוטוקולים ייעודיים לטיפול בתא לחץ, היכולים להביא לחידוש של כלי דם מוחיים (אנגיוגנזיס) ונוירופלסטיות מוחית", מסביר ד"ר אמיר הדני. "בעבר הראינו את הפוטנציאל הטמון בטיפול זה לשיפור ולטיפול בפגיעה מוחית הנובעת משבץ, מפציעה או ממחסור ממושך בחמצן, על ידי הגברת זרימת הדם וחילוף החומרים במוח. המחקר הנוכחי מהווה ציון דרך ועשוי להשפיע באופן עמוק על האופן שבו אנו מתייחסים לתהליך ההזדקנות וליכולת לטפל בתסמיניה".
במהלך הטיפול שואף המטופל חמצן נקי בתוך תא לחץ, שלחץ האוויר בו כפול מזה השורר בסביבה הרגילה. תהליך זה מגביר את מסיסות החמצן בדם הזורם בגוף. בזמן שנמצאים בתוך התא נעשים שינויים לפרקי זמן קצובים בריכוזי החמצן, שמביאים לשחרור פקטורי גדילה ושגשוג של תאי גזע אשר מקדמים את ריפוי הרקמה.
נכון להיום הולכות ומצטברות ההוכחות להשפעתו הרגנרטיבית של הטיפול בתא לחץ. החוקרים הראו כי שילוב של רמות חמצן גבוהות (היפרוקסיה) ולחץ גבוה (סביבה היפרברית) מביא לשיפור משמעותי בחמצון רקמות, ומעורר הן גנים הרגישים לחמצן והן כאלה המגיבים ללחץ. כתוצאה מכך, חילוף החומרים ברקמות משתפר ומשתקם. יתרה מכך, אותם גנים מניעים התרבות מהירה של תאי גזע, מפחיתים דלקות, גורמים לייצור כלי דם חדשים ומפעילים מנגנונים של תיקון רקמות.
"סתימה של כלי דם קטנים, בדומה לסתימות הנוצרות בצנרת של בית 'מזדקן', מהווה מרכיב מרכזי בתהליך ההזדקנות של בני אדם. לכן, שיערנו שיצירת כלי דם חדשים במוח ע"י טיפול בתא לחץ עשויה להשפיע על ביצועים מוחיים באוכלוסייה המבוגרת", מסביר פרופ' אפרתי. "גילינו שהטיפול בתא לחץ מגביר משמעותית את זרימת הדם במוח במתאם עם שיפור קוגניטיבי, דבר המאשש את ההשערה שלנו. ניתן להניח שטיפול מסוג זה עשוי להשפיע בצורה מיטיבה גם על איברים אחרים בגוף המזדקן. בכוונתנו לבחון זאת במחקרים עתידיים."
פרופ' אפרתי וד"ר הדני מציינים כי הפרוטוקול הוא פרוטוקול ייחודי היכול להינתן רק במרכזים מסודרים עם תאים גדולים, המאפשרים את השינויים בריכוזי החמצן, שהכרחיים כדי לעורר את ייצור תאי גזע וריפוי רקמת המוח. ראש קבוצת המחקר פרופ' שי אפרתי מספר כי כעת נפתחים מרכזים היפרברים נוספים בעולם, העובדים בסינוף ובשיתוף פעולה עם מרכז סגול במטרה לשפר ביצועים מוחיים וגופניים של אנשים בגיל המבוגר, על סמך הפרוטוקול הטיפולי שפותח בישראל. המרכז הראשון הגדול ביותר בארה"ב נפתח והתחיל לעבוד בפלורידה לפני כחודש.

מחקר
עטלפים מנווטים באמצעות ראיה מצוינת ומפה מנטלית, בדיוק כמו בני האדם

לראשונה, חוקרים מאוניברסיטת תל אביב עקבו אחר עטלפי פירות מרגע צאתם לעולם עד לבגרות, בניסיון להבין כיצד הם מנווטים למרחקים ארוכים. התוצאות המפתיעות: עטלפי פירות בונים במוחם מפה קוגניטיבית ראייתית של המרחב בדיוק כמו בני אדם, ומשתמשים בנקודות ציון בולטות בניווט. עוד תכונה מעניינת שנחשפה: גם עטלפים עושים קיצורי דרך כשהזמן דוחק והבטן מקרקרת.
"שאלת היכולת של בעלי חיים לנווט למרחקים היא חידה מחקרית עתיקה, ועטלפים, כידוע, הם אלופי העולם בניווט: הם עפים עשרות קילומטרים בתוך שעות ספורות וחוזרים לנקודת המוצא", מסביר מוביל המחקר פרופ' יוסי יובל מבית הספר לזואולוגיה בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז. "לצורך המחקר הזה השתמשנו במכשירי GPS הזעירים בעולם, פרי פיתוחנו, כדי לערוך ניסוי שלא נערך קודם: לעקוב אחר גורי עטלפים מהרגע שבו הם פורשים כנף ועד לבגרות, כדי להבין כיצד מתפתחת יכולת הניווט שלהם מאפס. לא נערך מחקר דומה על אף בעל חיים, והתוצאות מעניינות מאוד". גורי העטלפים ממושבת העטלפים של אוניברסיטת תל אביב למדו להכיר את העיר באמצעות מבנים גדולים ומיוחדים, כמו מגדלי עזריאלי, דיזנגוף סנטר וכדומה.
את המחקר פורץ הדרך ערכו פרופ' יובל והסטודנטים אמיתי כץ, לי הרתאן, איה גולדשטיין ומיכל הנדל, מהמעבדה לתפיסה חושית וקוגניציה במחלקה לזואולוגיה, והוא התפרסם על שער כתב העת היוקרתי Science.
החוקרים עקבו אחר 22 גורי עטלפי פירות ממושבת העטלפים המיוחדת, שנמצאת באוניברסיטה עצמה, מינקותם ועד גיל בגרות, כשהם סורקים את העיר בחיפוש אחר מזון. תוצאות המחקר מראות כי העטלפים התל אביביים מנווטים במרחב בדומה מאוד לתל אביבים האנושיים.
"צריך להבין שעטלפים מנווטים באמצעות סונאר למרחקים קצרים בלבד, ליד עץ למשל", אומר פרופ' יובל. "לניווט למרחקים ארוכים משתמשים עטלפי הפירות בחוש הראייה. בסך הכול מיפינו כ-2,000 לילות תעופה של עטלפים בתל אביב, וגילינו שהעטלפים בונים לעצמם מפה מנטלית. הם לומדים לזהות ולהשתמש בציוני דרך כמו מגדלי עזריאלי, תחנת הכוח רידינג וקומפלקסים מובהקים אחרים בתל אביב כנקודות ציון ויזואליות. הראיה המובהקת ביותר לכך היא קיצורי הדרך. כמו בני אדם, בשלב מסוים גם העטלף מגיע מנקודה לנקודה בקו שהוא עוד לא עף בו. מאחר שאנחנו הכרנו את היסטוריית התעופה של כל עטלף מאז שהיה גור, ידענו להצביע ולהגיד - הנה, כאן הוא עושה קיצור דרך בפעם הראשונה. ובאמת ראינו שבמסלולים חדשים ולא מוכרים, העטלף עף גבוה מעל לבניינים. נעזרנו ברחפנים אותם העלינו למיקום ולגובה שבו עפים העטלפים, וראינו שאכן מדובר בזווית ראייה שממנה אפשר לראות בבירור את מגדלי העיר. זו עוד דוגמא מופלאה לכך שבעלי חיים עושים שימוש ביציר כפיהם של בני אדם".
"תהליך העיור המואץ הוא אחד הגורמים העיקריים לחיסול שטחי המחיה של בעלי חיים רבים. הבנה טובה יותר של התמודדות בעלי החיים עם העיר, כמו למשל כיצד הם מנווטים בה, תסייע לשמור על מגוון המינים ההכרחי למערכת האקולוגית", מסכם פרופ' יובל.

מחקר
נמצאה הדרך לוויסות התנהגות חברתית מוגברת, שמקורה בחסר בגן מסוים

דמיינו לכם שילד זר ניגש אליכם סתם כך במקום ציבורי, מחייך אליכם ורוצה מאוד להפוך לחבר הכי טוב שלכם. נשמע תמים? יכול להיות, אך ככל הנראה שמדובר באחד מכ-800,000 הלוקים בתסמונת ויליאמס. מדובר בפגיעה גנטית, שבאה לידי ביטוי, בין היתר, בהפרעת התנהגות חברתית. הלוקים בה הם ילדים שמחים, חיוניים, קופצניים ולבביים במיוחד, שלא מצליחים לעצור את עצמם מלהעניק אהבה לסביבה ולרצות להכיר אנשים חדשים כל הזמן. על פניו זה נשמע כמו תסמונת מקסימה ואופטימית, במיוחד בימים שבהם הניכור וההתבודדות החברתית רק הולכים ומחמירים, אבל יש בה גם צדדים פחות חיוביים, כמו מוגבלות שכלית ובעיות בריאות משמעותיות.
המעבדה של ד"ר בועז ברק מבית הספר סגול למדעי המוח ומבית הספר למדעי הפסיכולוגיה, חוקר נוירו-גנטיקה של הפרעות התנהגות, נמצאת על סף פריצת דרך מדעית, שתאפשר ללוקים בתסמונות הקשורות ליכולות חברתיות, לווסת התנהגות לרמות נורמליות, הן מצד החולים בתסמונת ויליאמס, שאצלם יש חברותיות יתר, ובתקווה שגם לאלו מהצד השני הסובלים מחסך בחברתיות, כפי שהיא מופיעה אצל הלוקים על הספקטרום האוטיסטי למשל.
תסמונת ויליאמס היא תסמונת גנטית נדירה, הנגרמת בגלל הפרעה כרומוזומלית. "מדובר בחסר של 27-25 גנים בכרומוזום מסוים, שקיים אצל 95% מהלוקים בה", מסביר ד"ר ברק, שחוקר את הסיבות הגנטיות להפרעות התנהגות חברתית ספציפית, עם דגש על שתי תסמונות: אוטיזם, שם יש חסך בהתנהגות חברתית, ותסמונת ויליאמס. "מתוך 25 הגנים המדוברים יש גן שנקרא GTF2I, שלאחר הפגיעה בו מופיעה ההתנהגות החברתית המוגברת. אנחנו רצינו להבין מדוע חסר בגן הזה מוביל להתנהגות המוגברת הזו".
כדי לחקור את חשיבות הגן באזור מוחי מסוים ובאוכלוסיית תאים מסוימת, השתמש ד"ר ברק בחיית מודל, אשר הונדסה גנטית כדי להוות מודל לתסמונת. "במקום לפגוע בביטוי הגן בכל גוף העכבר, הינדסנו אותו כך שפגענו בגן זה באזורי מוח מסוימים בלבד אצל העכברים, וגילינו שפגיעה זו מספיקה כדי לעודד חברתיות יתר", הוא מספר.
"כעת רצינו לראות אילו מהגנים בקליפת המוח החיצונית של העכברים, באים לידי ביטוי אצל עכבר חולה לעומת עכבר בריא. לכן ערכנו לכל אחד מהם ריצוף גנטי. אצל העכברים החולים ראינו ירידה ברמת ביטוי גנים רבים, וגילינו ש-70% מהגנים שביטויים ירד בצורה משמעותית במוח של החיה החולה - קשורים למיאלין (מיאלין הוא החומר שעוטף ומבודד את הסיבים העצביים במערכת העצבים, כדי שיוכלו להעביר את הדחפים העצביים כהלכה, ובכך להוביל לתקשורת תקינה בין תאי העצבים במוח). כששכבת המיאלין אינה תקינה, מהירות ההולכה של האות החשמלי איטית יותר, הוא דועך ובעצם לא מגיע ליעדו, ואז יש פגיעה בתפקוד של תא העצב וכתוצאה מכך בתפקוד של אזורי המוח השונים".
כך גילתה קבוצת המחקר עדות ראשונה לכך שבתסמונת ויליאמס ישנה פגיעה בבידוד של עצבי המוח, וכתוצאה מכך - בתפקוד שלהם. "הוכחנו שיש ירידה בביטוי של גנים שקשורים במיאלין, וגילינו שמספר התאים שמייצרים מיאלין קטן יותר בקרב חיות המודל לתסמונת, ובדגימות מוח שנלקחו מאנשים שסבלו מהתסמונת ונפטרו. פגיעות אלה מובילות לפגיעה בעובי המיאלין, שהוא דק יותר ופחות פונקציונלי. כל אלו גורמים לבעיית מוליכות עצבית ולפגיעה בהתנהגות מוטורית, שידוע שהיא נפגעת כשיש פגיעה במיאלין".

חתך רוחבי של שלוחת תא העצב (אקסון) אשר עטופה בשכבת מיאלין (בשחור), במוח עכבר המודל (צילום מיקרוסקופ אלקטרוני: ד"ר בועז ברק)
משגילו מה לקוי אצל החולים בתסמונת ויליאמס, הבינו החוקרים שהפגיעה במיאלין בתסמונת ויליאמס דומה למצב הקיים אצל חולי טרשת נפוצה (אך הנובע מסיבות שונות), שם הגוף חושב שהמיאלין הוא גוף זר ותוקף אותו. "החלטנו לתת תרופות שניתנות בטרשת נפוצה כבר 20 שנה ומוכחות כבטוחות וטובות, לאנשים עם תסמונת ויליאמס".
החוקרים נתנו לעכברים תרופה שמשפרת את המוליכות העצבית, ותרופה נוספת שמגבירה ייצור של מיאלין. שתי התרופות מאושרות ע"י ה-FDA. הן ניתנות באופן שיטתי לחולי טרשת נפוצה במטרה לעכב את התפתחות המחלה, ונחשבות לבטוחות.
"למרבה השמחה התרופות שיפרו את המוליכות העצבית ואת ההתנהגות החברתית והמוטורית של עכברי המודל לתסמונת", אומר ד"ר ברק ומוסיף "כעת אנחנו בפתחם של ניסויים קליניים גם בבני אדם, שייקחו חלק בניסוי במשך שלושה חודשים, בשיתוף עם פרופ' דורון גוטהלף, פסיכיאטר ילדים מהמרכז הרפואי שיבא. מדובר בתרופה שמדרבנת תאים מייצרי מיאלין לעשות את עבודתם, מה שלא קורה באופן טבעי אצל הלוקים בתסמונת ויליאמס וגם אצל חולי טרשת נפוצה, ואנחנו מקווים שהיא "תנרמל" את תהליך ייצור המיאלין בגוף החולים".
ד"ר ברק מקבל פניות קורעות לב של הורים לילדים הלוקים בתסמונת מכל העולם, אשר מבקשים לקבל את התרופה ולהשתתף בניסוי. "מצד אחד זה קשה, כי הרי אי אפשר לקבל את כולם, ומצד שני זה אחד הדברים שמדרבנים להמשיך ולעבוד על המחקר ולמצוא את הפתרון לתסמונת המורכבת הזו".
לשאלה האם בעקבות הגילוי יהיה אפשר 'לשחק' עם רמות הגן, כדי להשפיע על ההתנהגות החברתית, ולתת למי שיחפוץ בכך 'מנת אהבה', עונה ד"ר ברק בחיוך "ללא ספק, מדובר בדיון פילוסופי מורכב, שהרי יש גם מי ששואל 'מי אמר שילד הלוקה בתסמונת היה רוצה שירפאו אותו מזה?'"

מחקר
השיטה פורצת הדרך, שעושה שימוש בחוש הריח, עשויה לסייע לשיקומם של נפגעי פוסט טראומה ואנשים עם פגיעה מוחית

"אנחנו יודעים שבמהלך השינה מתרחש במוח תהליך של התגבשות הזיכרון (קונסולידציה)," מסביר פרופ' יובל ניר מביה"ס סגול למדעי המוח באוניברסיטת תל אביב. "זיכרונות שנצברו לאחרונה במאגר הזיכרון לטווח קצר שנמצא בהיפוקמפוס מועברים בהדרגה למאגר הזיכרון לטווח ארוך בקליפת המוח. במחקר זה ביקשנו לבחון לעומק את תהליך התגבשות הזיכרון במוח במהלך השינה – על ידי השוואה בין הפעילות המוחית באזורים שבהם הוא מתרחש לפעילות באזורים שבהם הוא אינו מתרחש."
המחקר המשותף של אוניברסיטת תל אביב ומכון ויצמן למדע הניב שיטה חדשנית לבדיקה ולהשפעה נפרדת על תהליך התגבשות הזיכרון בצד אחד של המוח במהלך השינה. השיטה, המתבססת על הזרמת ניחוח מעורר זיכרון לאחד הנחיריים בלבד, עשויה בעתיד לסייע בחיזוק הזיכרון בצד הפגוע אצל נפגעי מוח. בנוסף היא עשויה לסייע בהשבת האיזון למוחם של נפגעי פוסט-טראומה.
מובילי המחקר הם: אלה בר, דוקטורנטית משותפת של אוניברסיטת תל אביב ומכון ויצמן למדע, פרופ' יובל ניר מביה"ס סגול למדעי המוח והמחלקה לפיזיולוגיה ופרמקולוגיה בבית הספר לרפואה של אוניברסיטת תל אביב, פרופ' ידין דודאי, פרופ' נעם סובל ופרופ' רוני פז מהמחלקה לנוירוביולוגיה במכון ויצמן למדע. המחקר התפרסם בכתב העת Current Biology.
משתתפי המחקר התבקשו ללמוד את מיקומן של מילים שהופיעו מולם על מסך בזו אחר זו – חלקן מימין וחלקן משמאל. "ידוע לנו ממחקרים אחרים שדברים המופיעים בשדה הראיה השמאלי נשמרים בצדו הימני של המוח, ולהפך," אומרת אלה בר. "מבלי שהנבדקים ידעו על כך, חילקנו את המילים באופן שווה – חציין הופיעו מימין וחציין משמאל." בנוסף, במהלך הלמידה, הוזרם ריח נעים של ורדים דרך מסיכה שכיסתה את אפם של הנבדקים. מיד לאחר הלמידה ביצעו הנבדקים מבחן זיכרון על המילים אותן הם למדו.
לאחר מבחן הזיכרון התבקשו הנבדקים לישון בחדר שיועד לכך. בעזרת מתקן שתוכנן במיוחד, המפריד בין הסביבה הנשימתית של שני הנחיריים, החדירו החוקרים פולסים של ניחוח ורדים רק לאחד הנחיריים של הנבדק הישן. "הריח, שקושר במוחם של המשתתפים למטלת הלמידה שבוצעה קודם לכן, הגיע מהנחיר אליו הוא הוזרם אל החלק של המוח באותו הצד," אומרת אלה. "אנחנו בדקנו את השפעתו על תהליך התגבשות הזיכרון בצד המושפע מהריח לעומת הצד שלא קיבל פולסים של ריח ורדים."
החוקרים נעזרו במכשיר EEG כדי להשוות בין גלי המוח בשני צידי המוח. ואלו היו הממצאים:
"השיטה שפיתחנו מאפשרת לראשונה להשוות בין תהליכי התגבשות הזיכרון בשני צדי המוח – באותו אדם ובאותו שלב של השינה, והיא תסייע לנו ולחוקרים אחרים במחקרי המשך להבנת תרומת השינה לזיכרון," מסכם פרופ' ניר. אלה מוסיפה: "בנוסף מצאנו שהשיטה מעצימה את התגבשות הזיכרון באחד מצדי המוח, ולכן היא עשויה לשמש בסיס לפיתוח טיפולים בקליניקה. טיפול כזה עשוי לסייע למטופלים עם פגיעה מוחית בעקבות תאונה או שבץ, וגם לנפגעי פוסט טראומה - אצלם יש פעילות יתר של צידו הימני, הרגשי, של המוח בעת היזכרות בחוויה הטראומטית; חיזוק הצד השמאלי, האחראי לביטוי המילולי של הטראומה, עשוי לייצר איזון ולסייע להם בהתמודדות."

מחקר
מערכת חדשנית המחברת בין מספר איברים-על-שבב סוללת את הדרך למהפכה בפיתוח תרופות

חוקרים מאוניברסיטת תל אביב הצליחו לפתח מערכת חדשנית המחברת בין מספר איברים-על-שבב, ומדמה את פעולתן של מערכות שלמות בגוף האדם. השיטה החדשנית עשויה לחולל מהפכה של ממש בתהליך של פיתוח תרופות, שאורך כיום שנים ארוכות ועולה כסף רב, ולמרות זאת יעילותו חלקית ביותר. יתרון אפשרי נוסף של הטכנולוגיה החדשה הוא מניעת הבעיות האתיות הכרוכות בניסויים בבעלי חיים.
המחקרים בוצעו בשיתוף עם אוניברסיטת הרווארד, ובהשתתפות 57 חוקרים ממוסדות מחקר ומחברות לפיתוח תרופות בעולם. שני המאמרים פורסמו בכתב העת Nature Biomedical Engineering בינואר 2020.
"פיתוח תרופות כרוך היום בתהליך שאורך 20-10 שנה, ועולה כ-2-1 מיליארד דולר לתרופה," מסביר ד"ר בן מעוז מהמחלקה להנדסה ביו-רפואית ומבית ספר סגול למדעי המוח באוניברסיטת תל אביב, שנמנה על מובילי הפרויקט הבינלאומי. "מתוכו, כ-6-3 שנים מוקדשות לניסויים בתרביות ובבעלי חיים, ועוד כ-8-6 שנים מוקדשות לניסויים קליניים בבני אדם. ולאחר כל המאמץ וההשקעה, מסתבר שהתהליך אינו יעיל: כ-90-60% מהתרופות שמיטיבות עם בעלי חיים נכשלות בבני אדם. מצב זה גורם לחוקרים בכל העולם לחפש הליכים חלופיים לפיתוח תרופות. אחת הטכנולוגיות בעלות הפוטנציאל הגדול ביותר בתחום היא OOC (Organ-on-a-Chip), או בעברית 'איבר-על-שבב." במסגרת השיטה, שפותחה לראשונה ב-2010 באוניברסיטת הרווארד, משתמשים המדענים בתאים מאיבר אנושי מסוים – לב, מוח, כליה, ריאות וכדומה, ובעזרת טכניקות של הנדסת רקמות מניחים אותם במחסנית מפלסטיק – הלא היא השבב.
בשנים האחרונות פותח בעולם מגוון רחב של 'איברים-על-שבב' המתפקדים כמו האיבר האנושי עצמו. ד"ר מעוז פיתח לפני כשנתיים איבר-על-שבב המחקה את פעולתו של מחסום הדם-מוח, ובמקומות אחרים פותחו שבבים של לב, כליות, מעיים ועוד. בפרויקט הנוכחי פותחה לראשונה מערכת שמסוגלת לחבר בין השבבים השונים, ומאפשרת לדמות את פעולתן של מערכות שלמות בגוף האדם, ואת תגובתן לתרופות ניסיוניות המוזנות למערכת.
המערכת פותחה ונבחנה בשני מחקרים: במחקר הראשון פיתחו החוקרים מערכת רובוטית אוטומטית שיכולה לחבר באופן פשוט ומודולרי בין שבבים של עד 10 איברים שונים, ומאפשרת שליטה בכל חומר שנכנס לכל שבב ויוצא ממנו. בנוסף הם יצרו עבור הרקמות שעל השבבים סביבה ביולוגית מתאימה ותומכת, מעין 'דם מלאכותי', שמאפשר להן לתפקד ולתקשר ביניהן לאורך זמן. החוקרים הציבו במערכת 9 איברים-על-שבב – מוח, מחסום הדם-מוח, ריאות, לב, מח עצם, כליה, מעי, כבד ועור, ונוכחו כי היא פועלת בהצלחה במשך שלושה שבועות לפחות.
במחקר השני הוסיפו החוקרים תרופות שונות למערכת האוטומטית, ובדקו כיצד מגיבים האיברים השונים. ראשית הוחדר למערכת ניקוטין, חומר שבדרך כלל נלקח דרך הפה כדי לסייע בגמילה מעישון, ונבחן כיום גם כתרופה למחלות ניווניות ולדלקות כרוניות של המעי. "עבור תרופות הנלקחות דרך הפה יש חשיבות גדולה לתהליך הקליטה של התרופה בגוף - דרך המעי שסופג אותה, הכבד שמפרק אותה ולבסוף הכליה שמסננת את החומר," אומר ד"ר מעוז. "לכן, עבור הניקוטין, היצבנו בפלטפורמה שלנו שבבים של שלושת האיברים הללו." התרופה השנייה שנבדקה הייתה ציספלטין, מרכיב נפוץ בטיפולים כימותרפיים לסרטן הניתנים דרך הווריד. עבורה הוצבו במערכת שבבים של כבד וכליה, וכן שבב של מח עצם, המושפע מאוד מהתרופה.
האתגר הבא היה להתאים את התוצאות שנמדדו בפלטפורמה החדשנית לגוף האדם כמערכת כוללת, ולגשר על הפערים ביניהם. לשם כך פיתחו החוקרים מודלים חישוביים שמתרגמים את הערכים שהתקבלו במערכת לתוצאות מקבילות של בדיקות קליניות בבני אדם. ואכן, השילוב בין המערכת האוטומטית של איברים-על-שבב למודלים החישוביים הניב ערכים קרובים מאוד לאלה שנמדדו אצל מטופלים אנושיים בקליניקה.
"לראשונה בעולם הצלחנו לפתח פלטפורמת איבר-על-שבב מהימנה וגמישה, שנותנת תוצאות קרובות מאוד לאלה המתקבלות אצל מטופלים אנושיים," מסכם ד"ר מעוז. "כבר היום, לאחר שרשות התרופות האמריקאית (FDA) הודיעה כי היא תומכת בפיתוח איברים-על-שבב שישמשו ככלי תומך לפיתוח תרופות, יכולות חברות ומעבדות העוסקות בתחום להיעזר במערכת שלנו. כמו כן אנו מאמינים ומקווים שבעתיד, לאחר פיתוח נוסף, תוכל הפלטפורמה החדשה לשמש כחלופה לניסויים בבעלי חיים ואף לחלק ניכר מהניסויים הקליניים בבני אדם. כך היא תחסוך שנים של מחקר, כסף רב וגם סבל של בני אדם ובעלי חיים כאחד."

מחקר
האם לעטלף קל יותר לזהות נחיל חרקים או דווקא חרק בודד? מחשבות על ארוחת ערב

העטלפים משתמשים בסונר הטבעי שלהם כדי לצוד ולהתמצא במרחב. מחקר חדש של חוקרים באוניברסיטת תל אביב, בהובלת פרופ' יוסי יובל וד"ר אריאן בונמן מבית הספר לזואולוגיה ומבית הספר סגול למדעי המוח, חושף ממצאים חדשים לגבי האופן שבו הם מזהים וצדים נחילי חרקים. הממצאים עשויים לשפוך אור על התפתחות חוש הסונר אצל עטלפים לפני עשרות מיליוני שנים, ולסייע בפיתוח טכנולוגיות הגנתיות והתקפיות עבור נחילי רחפנים בשימוש ביטחוני עתידי.
"מרבית העטלפים צדים חרקים ומשתמשים לשם כך בסונר הטבעי שלהם. הם משדרים גלי קול, וההד המוחזר מהחרק מאפשר להם לגלות ולאכן אותו," מסביר פרופ' יובל. "עד היום נערכו מחקרים רבים על הדים המוחזרים מחרקים בודדים, אך לא על נחילי חרקים שבהם מתקבצים יחדיו מאות ולעיתים אלפי פרטים. במחקר שלנו נעזרנו בטכנולוגיה חדשה, כדי לבחון לראשונה את ההדים המוחזרים לעטלף מנחילי חרקים".
החוקרים פיתחו אלגוריתם שאיפשר להם ליצור במחשב סימולציות תלת-ממד אקוסטיות של נחילי חרקים, ולמדוד את ההד המוחזר מהנחיל, תוך שינוי מספר החרקים בנחיל והמרחקים בין החרקים. בנוסף, כדי לאמת את ממצאיהם, הקליטו החוקרים הדים המוחזרים מנחילים בטבע ומדגמים של חרקים במעבדה.
"הממצא הראשון, שאינו מפתיע, הוא שנחיל ניתן לגילוי ממרחק גדול בהרבה בהשוואה לחרק בודד," אומר פרופ' יובל. "עם זאת הופתענו לגלות שעבור נחיל כלשהו, ההד דווקא נחלש מכיוונים מסוימים, אפילו בהשוואה להד המוחזר מחרק בודד. ההסבר לכך טמון בתופעה של התאבכות הורסת – כאשר גלי קול בעלי אמפליטודות מנוגדות נפגשים ומבטלים זה את זה". המאמר התפרסם לאחרונה בכתב העת PLOS Computational Biology.
"הממצאים שלנו משליכים על מספר נושאים מעניינים," מסכם פרופ' יובל. "ראשית, הם עשויים להעניק לנו תובנות חדשות בנוגע לאבולוציה המוקדמת של הסונר: ייתכן שהעטלפים הקדומים, שחיו לפני 50 מיליון שנה והיו מצוידים בסונר פרימיטיבי יחסית, שאינו מסוגל לזהות חרקים בודדים, הצליחו למצוא מזון על ידי איתור נחילים שלמים.
שנית, הממצאים מסבירים את הימצאותם של חרקים זעירים בגללים של עטלפים בני זמננו, גם כשברור שגודלם אינו מאפשר גילוי של חרק בודד על ידי הסונר. ושלישית, הם מספקים הסבר חדש לעובדה ידועה - שעטלפים משדרים גלי קול במגוון תדרים שונים. ייתכן שתכונה זו נועדה למנוע את תופעת ההתאבכות, שעלולה להחליש את האות המוחזר מנחילי חרקים".
ד"ר בונמן מוסיף כי האלגוריתמים שפותחו עבור המחקר עשויים להתאים גם לנחילי רחפנים המשמשים לצרכים ביטחוניים, ולסייע בפיתוח יישומים לגילוי רחפנים של האויב, או לחלופין להסתרת רחפנים 'שלנו' ממכ"מי האויב.

מתחקים אחר הדי נחילי חרקים. פרופ' יובל וד"ר בונמן

מחקר
טיפול בתרופה ניסיונית עשוי למנוע את השפעתן השלילית של מוטציות גנטיות המאפיינות אוטיזם ואלצהיימר

"עם התפתחות הטכנולוגיה של ריצוף DNA, אותרו בשנים האחרונות מוטציות רבות במאות גנים בילדים עם אוטיזם ומוגבלות שכלית התפתחותית. מדובר במוטציות אקראיות שלא הועברו בתורשה מההורים, אלא התרחשו בתאי הגזע של העובר, במהלך התחלקות התא. בילדים, מוטציה אחת בגן חשוב יכולה לגרום לאוטיזם ולפיגור שכלי." מסבירה פרופ' אילנה גוזס, מבית הספר לרפואה ע"ש סאקלר ומבית הספר סגול למדעי המוח. "בשלב הראשון ביקשנו לבדוק האם גם בתאים במוחם של חולי אלצהיימר מופיעות מוטציות, והאם קיימת חפיפה בין המוטציות המאפיינות אלצהיימר ואוטיזם."
כעת, קבוצת החוקרים בהובלת פרופ' גוזס מצאה חפיפה גבוהה בין מאות מוטציות המאפיינות ילדים עם אוטיזם ומוגבלות שכלית התפתחותית, לבין מוטציות במוחם של חולי אלצהיימר. החוקרים התמקדו במיוחד במוטציות בגן ADNP, שיש לו תפקיד חשוב בהתפתחות המוח ובהגנה על מבנה תאי העצב במוח. הם מצאו כי טיפול באמצעות מקטע מקוצר של החלבון ADNP, הקרוי NAP, עשוי להגן על המוח מפני השפעת המוטציות, ולסייע לחולי אלצהיימר ולאוטיסטים.
החוקרים בחנו דגימות שנלקחו מאזור פקעת ההרחה במוחם של חולי אלצהיימר, לאחר מותם. ריצוף ה-RNA של הגנום בדגימות פקעת ההרחה העלה מאות מוטציות. בנוסף בדקו החוקרים נתונים מכמה מאגרי מידע אינטרנטיים, ומצאו גם כאן מוטציות באלפי גנים במוחם של חולי אלצהיימר – הרבה יותר (בממוצע לנבדק) מאשר במוח בריא. הם השוו את ממצאיהם לממצאים ממחקרים על מוטציות הקשורות לאוטיזם. "מצאנו חפיפה משמעותית: כ-40% מהמוטציות בגנים מחוללי מחלות שזיהינו בפקעת ההרחה של חולי אלצהיימר אותרו גם בילדים עם אוטיזם ומוגבלות שכלית," אומרת פרופ' גוזס.
כעת עברו החוקרים לבדיקה מעמיקה של גן ספציפי - הגן ADNP, האחראי בין היתר לתסמונת ADNP שגורמת לאוטיזם ולמוגבלות שכלית, וידוע כי הוא קשור גם למחלת האלצהיימר. "החלבון ADNP, המיוצר על ידי הגן ADNP, התגלה במעבדה שלי לפני כ-20 שנה, ומאז ערכנו עליו מחקרים רבים," אומרת פרופ' גוזס. "במהלך השנים התברר כי ל-ADNP יש תפקיד מרכזי בהתפתחות המוח בעובר, וכי פעולתו קשורה לחלבון Tau, הנקשר לשלד תאי העצב במוח ומייצב את מבנה התא, וידוע כי הוא נפגע אצל חולי אלצהיימר. בעבר הפקנו מהחלבון ADNP מקטע מקוצר בשם NAP, המשמש בסיס לתרופה ניסיונית לאוטיזם. במחקר הנוכחי מצאנו מספר מוטציות חדשות בגן ADNP במוחם של חולי אלצהיימר. כמו כן גילינו שככל שעולה מספר המוטציות ב-ADNP במוחם של החולים, עולה גם הפתולוגיה של החלבון Tau."
בשלב הבא נעזרו החוקרים בהנדסה גנטית כדי להחדיר ADNP עם 2 מוטציות שמקצרות את החלבון, וכן Tau מסומן בצבע זוהר, לתאי מודל של תאי עצב מוחיים. בדיקת צביעת ה-Tau בתאים החיים העלתה כי המוטציה ב-ADNP גרמה לפגיעה בהיקשרות ה-Tau לשלד תא העצב, וכתוצאה מכך להיחלשות של שלד התא. עם זאת נמצא כי טיפול בתרופה הניסיונית NAP (הידועה גם בשם 201CP) הגן על מבנה שלד תאי העצב מפני ההשפעה המזיקה, והשלד נותר יציב ותקין.
פרופ' גוזס מציינת כי ממצאים אלה מעידים שמנגנון פעולה תקין של ADNP דרוש להיקשרות תקינה של Tau לשלד התא, ואילו מוטציות ב-ADNP משבשות את המנגנון. החזרת המקטע NAP מזרזת את קישור החלבון Tau לשלד התא, ובכך מגינה על התא מפני השפעתן המזיקה של מוטציות ב-ADNP.
"המחקר שלנו פותח אופק חדש למחקר ולטיפול במחלת אלצהיימר ובאוטיזם," מסכמת פרופ' גוזס. "עד היום התמקדו חוקרי אלצהיימר בעיקר במצבורי העמילואידים שנוצרים במוחם של חולי אלצהיימר. המחקר שלנו מפנה את תשומת הלב לכיוון אחר – מוטציות שמשפיעות על החלבון Tau, ובכך גורמות לפגיעה במבנה של תאי העצב במוח. יותר מכך, התרופה הניסיונית שאנחנו מפתחים עשויה לסייע לחולי אלצהיימר וגם לאוטיסטים עם מוטציות הדומות לאלה של מחלת האלצהיימר."
חשוב לציין: החברה הישראלית קורוניס נוירוסיינס מחזיקה בזיכיון לפיתוח התרופה 201CP, המבוססת על המקטע NAP, מחברת רמות שליד אוניברסיטת תל אביב. החברה מפתחת תרופה ניסיונית לאוטיזם מסוג תסמונת ADNP, שנגרמת על ידי מוטציה אקראית בגן ADNP. הפיתוח נעשה תחת התוויה של תרופת יתום ממנהל המזון והתרופות האמריקאי (FDA).
במחקר השתתפו הדוקטורנטים ינינה איבשקו פחימה, אדוה הדר (סופרות ראשונות), איריס גריג, אוקסנה קפיטנסקי וגדעון כרמון ממעבדתה של פרופ' גוזס, פרופ' דוד גורביץ מבית הספר לרפואה באוניברסיטת תל אביב (מדריך משותף של אדוה הדר), מיכאל גרשוביץ ממכון ויצמן למדע, ומעבדות בצ'כיה, בספרד, בבלגיה ובאנגליה. המאמר פורסם לאחרונה בכתב העת Molecular Psychiatry.

מחקר
מחקר חדש מגלה כי במצבים מסוימים עטלפים מעדיפים את חוש הראייה על פני חוש הסונר

העטלפים ניחנו ב'חוש שישי', הוא חוש הסונר (גלי קול המשוגרים ומוחזרים מעצמים מהסביבה), כדי להתמצא ולנוע בסביבה כשחשוך במיוחד. אבל החוקרים במעבדת העטלפים בגן הזואולוגי של אוניברסיטת תל אביב, הגדולה מסוגה בעולם, גילו לאחרונה כי במצבים מסוימים מעדיפים היונקים המעופפים לשלב בין חוש הראייה לחוש הייחודי, ושפכו אור חדש על הנושא.
"עובדה ידועה היא כי לעטלפים יש חוש מיוחד במינו, המאפשר להם להתמצא בסביבה גם בחשיכה מוחלטת," אומר פרופ' יוסי יובל מביה"ס לזואולוגיה בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז, שהוביל את המחקר. "החוש, המכונה אקולוקציה, פועל בדומה לסונר המותקן בספינות, שתפקידו לסרוק את הסביבה התת-מימית: העטלפים משדרים גלי קול ומעבדים את ההדים המוחזרים מעצמים בסביבה. עובדה זו יצרה בקרב חלק מהציבור תפיסה מוטעית, לפיה עטלפים הם עיוורים. למעשה כל העטלפים רואים, ולעטלפי פירות מהסוג שחקרנו יש ראייה מצוינת, שבלילה היא אף טובה יותר מזו של בני אדם. במחקר ביקשנו לבדוק כיצד הם משלבים בין שני החושים: חוש הראייה והסונר."
המחקר, שנערך על ידי ד"ר סאשה דנילוביץ מביה"ס לזואולוגיה ובשיתוף עם ביה"ס סגול למדעי המוח, העלה כי במצבים מסוימים עטלפי פירות מסתמכים על חוש הראייה שלהם יותר מאשר על הסונר. יותר מכך, הם מסוגלים לתרגם את המידע הנקלט באמצעות חוש הסונר לתמונה ויזואלית. מאמר בנושא התפרסם בכתב העת Science Advances.

רואה 6:6. עטלף פירות במושבת העטלפים בגן הזואולוגי (צילום: ינס ריידל)
המחקר נערך באוכלוסיית עטלפי פירות החיה בגן הזואולוגי של האוניברסיטה. בשלב הראשון לימדו החוקרים את העטלפים להבחין בין קובייה חלקה לקובייה מחוררת בחשיכה מוחלטת, כלומר באמצעות הסונר בלבד. כל עטלף קיבל מנת מזון כאשר נחת על הקובייה 'הנכונה', וכך למד להעדיף אותה.
לאחר מכן הפכו החוקרים את המצב: הקוביות נחשפו לאור, אך הונחו בתוך תיבות פלסטיק שקופות וזהות שלא ניתן להבחין ביניהן באמצעות הסונר, מכיוון שהן מחזירות הדים זהים. העטלפים, שלמעשה ראו עכשיו את הקוביות לראשונה, ידעו לבחור בקובייה הנכונה. "המשמעות היא שהם יודעים לתרגם את המידע שנקלט בסונר לתמונה ויזואלית, לפחות באופן חלקי," מסביר פרופ' יובל.
בהמשך למדו העטלפים לבחור בין גליל למנסרה כאשר שני החושים (סונר וראייה) פעילים. לאחר מכן הם נחשפו שוב באור לשני העצמים, אלא שהפעם היו העצמים נתונים בקופסאות שקופות, המנטרלות את השימוש בסונר. העטלפים ביצעו את המשימה בהצלחה באמצעות חוש הראייה בלבד. לעומת זאת בחשיכה, כשהסונר בלבד עמד לרשותם, הם לא הצליחו להבחין בין העצמים. ממצא זה מעיד על כך שהם למדו לזהות את העצמים באמצעות ראייה ולא באמצעות סונר.
בחלקו השלישי של המחקר התעופפו העטלפים בפרוזדור המתפצל לשתי מנהרות: מנהרה שהקצה שלה פתוח, ומנהרה חסומה בסופה. "כשחסמנו את המנהרה בלוח שחור העטלפים תמיד עפו לעברו, כנראה משום שהלוח השחור נראה להם כפתח של מערה", אומר פרופ' יובל. "רק בקרבת הלוח הם הבחינו, באמצעות הסונר, שהמנהרה למעשה חסומה והסתובבו לאחור. כלומר: חוש הראיה היה הדומיננטי בקבלת ההחלטה לעוף לעבר 'הפתח' המדומה, אך חוש הסונר מנע התנגשות במחסום. המשמעות היא שהעטלפים מסוגלים לתמרן בין שני החושים באופן גמיש." לעומת זאת כשהפתח נחסם בלוח לבן, העטלפים תמיד בחרו במנהרה הפתוחה.
"במחקר שלנו הראינו במגוון שיטות כיצד העטלפים משלבים בין שני חושים עיקריים – חוש הראייה והסונר", מסכם פרופ' יובל. "גילינו שבמצבים רבים הם מסתמכים יותר על חוש הראייה ואף ממירים את המידע שנקלט בסונר לתמונה ויזואלית. לעומת זאת במצבים מסוימים, למשל כאשר הם מתקרבים לקיר, הם מסוגלים 'להחליף' ולהסתמך על הסונר".
"הבנת השילוב בין החושים אצל העטלפים עשויה לתרום גם להבנת השימוש שעושים בני אדם במידע רב-חושי (למשל כשאנחנו שומעים מכונית וגם רואים אותה מתקרבת), ואף לסייע בפתרון שאלות מרכזיות לגבי עיבוד חושי והאופן בו המוח משלב מידע המתקבל מחושים שונים", הוא מסכם.
מחקר
חוקרים פענחו חידה בת 100 שנה, שעסקה בוויסות פעילות המוח. הפתרון שגילו עשוי להוביל לפיתוח תרופות חדשות למחלות נוירולוגיות קשות

מחלת האפילפסיה היא קבוצת הפרעות עצביות, שמאופיינת בהתקפי פרכוסים. עד היום לא הצליחו אנשי המדע להבין מהו הגורם להתקפים ולחזות את הופעתם או את אורכם. נכון להיום, כ-30-40% מהחולים לא מקבלים כל טיפול, בהם ילדים החולים בתסמונת דרווה, שהיא צורה נדירה וקשה במיוחד של אפילפסיה בגיל הילדות.
חוקרים במעבדתה של פרופ' אינה סלוצקי מהפקולטה לרפואה ע"ש סאקלר ומבית ספר סגול למדעי המוח באוניברסיטת תל אביב גילו כי לאחר התאמה כימית, עשויה תרופה קיימת לטרשת נפוצה לסייע גם לחולי אפילפסיה. התגלית המרעישה התקבלה בזכות מחקר שערכו בנושא שמעסיק את עולם הרפואה והמדע כבר למעלה ממאה שנה: מהו המנגנון המווסת את הפעילות המוחית ושומר על יציבותה?
מסבירה פרופ' סלוצקי: "כבר בסוף המאה ה-19 החלו מדענים לחפש את המנגנון האחראי על ההומאוסטזיס, יכולתו של הגוף לשמור על סביבה פנימית יציבה, על אף השינויים המתחוללים בסביבה החיצונית. מזה כ-25 שנה בוחן המדע כיצד נשמר האיזון ברשתות עצביות באופן ספציפי. מדובר במנגנון הייצוב ההומאוסטטי, המהווה מעין 'תרמוסטט' של פעילות המערכת העצבית, ודואג להשיבה לנקודת האיזון (set point), לאחר כל אירוע שמגביר או מפחית את פעילותה. אך על אף כל המאמצים שהושקעו בנושא לאורך תקופה כה ארוכה, איש לא גילה עד היום את המנגנון שמווסת את נקודת האיזון עצמה".
"ידוע שהפרת האיזון באזורים שונים במוח מהווה גורם מרכזי במגוון רחב של מחלות מוחיות, בהן אפילפסיה, פרקינסון ואלצהיימר. עם זאת, מרבית המחקרים עד היום התמקדו בפגמים בתהליך הוויסות, ואילו אנו ביקשנו לבחון השערה אחרת: האם ייתכן שהמחלה נובעת מכך שנקודת האיזון עצמה חורגת מהנורמה? במילים אחרות: האם חלק מתהליך המחלה נובע מפגם הגורם לשימור נקודת איזון גבוהה או נמוכה מדי? כדי למצוא מענה התמקדנו במחלת האפילפסיה, המתאפיינת בפעילות יתר של רשתות עצביות באזור ההיפוקמפוס במוח".
מכיוון שידוע כי קיים קשר הדוק בין תהליכים מטבוליים (חילוף חומרים) לפעילות עצבית, וכי מחלת האפילפסיה מלווה בשינויים משמעותיים בפעילות המטבולית במוח, נעזרו החוקרים במודל ממוחשב למיפוי תהליכים מטבוליים בתאים, שפותח במעבדתו של פרופ' איתן רופין, מהמכונים הלאומיים לבריאות בארה"בה - NIH. החוקר ניר גונן, דוקטורנט במעבדתה של פרופ' סלוצקי, הציב במודל נתונים ממאגרים בינלאומיים של מידע גנטי של חולי אפילפסיה, ולאחר מכן 'כיבה' את פעילותו של כל אחד מהגנים בנפרד, כדי לבחון את השפעתו. המטרה הייתה לענות על השאלה: כיבויו של איזה גן מקרב את התאים ממצב אפילפטי למצב תקין?
המודל העלה כי לגן DHODH, המקודד את האנזים DHODH, יש ככל הנראה תפקיד מרכזי במחלת האפילפסיה ובפעילות המוחית המוגברת הקשורה אליה. "אנחנו יודעים שתרופה קיימת לטרשת נפוצה בשם 'טריפלונומיד', מדכאת את פעילות האנזיםDHODH בתאי הדם של מערכת החיסון. אנחנו בחרנו באותה תרופה כדי לבחון את השפעתה הישירה על תאי המוח," אומרת פרופ' סלוצקי.
הדוקטורנט בועז סטיר, אף הוא ממובילי המחקר, הוסיף את התרופה לתאי מוח בריאים במבחנה, ומצא כי היא אכן מעכבת משמעותית את הפעילות העצבית. בהמשך הוא גילה תופעה מעניינת: אם משאירים את התרופה במבחנה לאורך זמן - העיכוב הופך לקבוע. זאת בניגוד למרבית התרופות, המעכבות את פעילות התאים לזמן מוגבל בלבד, בגלל פיצוי הומאוסטטי שמחזיר את הפעילות לקדמותה, סביב נקודת האיזון ההתחלתית.
"תוצאות אלו רמזו כי יתכן ש-DHODH משפיע על נקודת האיזון עצמה," אומרת פרופ' סלוצקי. ואכן, בדיקה של תגובת התאים במבחנה (לאחר הטיפול בתרופה) למגוון גירויים, העלתה כי פעילותם חוזרת תמיד לנקודת האיזון החדשה, שהפכה לקבועה בהשפעת התרופה. "כלומר, תרופה הפועלת על הDHODH- יכולה 'לתקן' את נקודת האיזון שחרגה מהנורמה, ולהשיבה לרמה תקינה. ממש כמו שאנו משנים את הטמפרטורה בתרמוסטט של מזגן, כדי להביא אותה לרמה הרצויה לנו", היא מסבירה.

מימין לשמאל: דניאל זרחין, בועז סטיר, פרופ' אינה סלוצקי, ניר גונן (צילום: רחל סלוצקי)
בשלב הבא בחן הדוקטורנט דניאל זרחין את השפעת התרופה, בשני מודלים של אפילפסיה בעכברים: מודל אקוטי, שגורם להתקף אפילפטי מידי, ומודל גנטי-כרוני של תסמונת דרווה, הגורמת לאפילפסיה קשה בילדים ועמידה לרוב התרופות האנטי-אפילפטיות הקיימות היום.
הזרקת התרופה ישירות למוחם של העכברים הובילה לממצאים מעודדים ביותר: בשני המודלים נצפתה חזרה של פעילות המוח למצב תקין, לצד ירידה דרמטית בחומרת ההתקפים האפילפטיים.
לדברי החוקרים, עם התאמה נוספת לתרופה שנבדקה, היא עשויה להוות בסיס לפיתוח תרופות למגוון מחלות נוירולוגיות ונוירו-דגנרטיביות כמו אלצהיימר ופרקינסון, שגם הן, בדומה לאפילפסיה, מתאפיינות בחוסר איזון של הפעילות המוחית.
"גילינו מנגנון חדש האחראי על ויסות הפעילות המוחית בהיפוקמפוס, שעשוי לשמש בסיס לפיתוח תרופות עתידיות יעילות נגד אפילפסיה," מסכמת פרופ' סלוצקי. "תרופות המבוססות על העיקרון החדש עשויות לתת תקווה לכ-30%-40 מחולי האפילפסיה, שאינם מגיבים לטיפולים הקיימים היום, בהם ילדים. במחקר חדש שאנו עורכים כעת, אנחנו בוחנים את יעילות הגישה שלנו לטיפול באלצהיימר."
המחקר הובל על ידי הדוקטורנטים בועז סטיר, ניר גונן ודניאל זרחין ממעבדתה של פרופ' סלוצקי, בשיתוף עם חוקרים נוספים ממעבדתה: ד"ר אנטונלה רוגיארו, רפאלה עצמון, ד"ר נטע גזית, ד"ר גבריאלה בראון, ד"ר סמואל פררה, ד"ר אירנה וורטקין, ד"ר אילנה שפירא, ליאור חיים ומקסים קצנלסון. פרופ' איתן רופין מהמכונים הלאומיים לבריאות בארה"ב –NIH. עוד השתתפו מעבדותיהם של פרופ' תמר גייגר וד"ר מורן רובינשטיין מאוניברסיטת תל אביב ושל פרופ' דורי דרדיקמן מהטכניון. מאמר על המחקר פורץ הדרך התפרסם בכתב העת המדעי היוקרתי Neuron.

מחקר
הטיפול שעשוי למנוע פיגור התפתחותי ואוטיזם נמצא כבר בשלבי פיתוח התרופה

בכל הקשור להיריון וללידה, אנחנו בדרך כלל לא אוהבים הפתעות. ככל שהרפואה מתקדמת, גדל סל בדיקות ההיריון המומלץ לנשים, על מנת לאתר בעיות ומומים בעובר. המיכשור משתכלל גם הוא, ומבדיקות אולטראסאונד בשחור לבן, עברנו כבר מזמן לבדיקות צבעוניות בתלת מימד. אבל לצערנו, טרם נמצאה הדרך לאבחון מוקדם של אוטיזם - הפרעה התפתחותית-נוירולוגית בעלת דרגות שונות, שמקשה על האדם לקיים אינטראקציה חברתית ותקשורתית, וניתנת לאבחון בדרך כלל בשנים הראשונות לחיי הילד.
כ-0.17% מכלל הילדים האוטיסטים, סובלים מתסמונת ADNP - מוטציה גנטית הנמנית על הגורמים המרכזיים לעיכוב התפתחותי ולאוטיזם אצל ילדים. המוטציה שגורמת לתסמונת ADNP היא רנדומלית, לא צפויה וכנראה מתרחשת בזמן ההיריון – לא ברור מתי. אפשר לזהות את תסמונת ה-ADNP די מוקדם בילדים המתפתחים לאחר הלידה, הם לוקים בהתפתחות איטית מחד ובבקיעת שיניים מוקדמת מאידך, ולכן הדרך היחידה לשפר את המצב, היא רק לאחר הלידה.
חוקרים מאוניברסיטת תל אביב, בהובלת פרופ' אילנה גוזס מביה"ס לרפואה ע"ש סאקלר ומביה"ס סגול למדעי המוח, גילו כי טיפול מרגע הלידה באמצעות NAP - מקטע של הגן ADNP, שיש לו תפקיד מרכזי בהתפתחות הקוגניציה - 'נירמל' את התפתחותם של עכברי מודל לתסמונת ADNP. החוקרים מאמינים שהתגלית תסלול את הדרך לתרופה חדשה.
"לפני כ-20 שנה גילינו במעבדה שלי גן בשם ADNP, אשר בהיעדרו המוח אינו נוצר, והעובר מת בשלב מוקדם," אומרת פרופ' גוזס. "בהמשך מצאנו שלאותו גן יש תפקיד בהתפתחות הקוגניציה, וכי עוברים עם חסר חלקי ב-ADNP ישרדו, אך יסבלו במהלך חייהם מפיגור שכלי, ולרוב גם מאוטיזם. כמו כן איתרנו והפקנו מהחלבון המקודד על ידי הגן מקטע פעיל ששמו NAP. בשנים האחרונות, עם התפתחות הטכנולוגיה של ריצוף גנטי, התגלו אצל חלק מהילדים האוטיסטים ו/או עם פיגור שכלי מוטציות אקראיות בגן ADNP, המתחוללות כנראה במהלך ההיריון: החלבון הנוצר קצר מהרגיל, וכתוצאה מכך, הילדים סובלים מחסר חלקי ב-ADNP. תופעה זו מכונה תסמונת ADNP, ואנחנו ביקשנו לבדוק אם היא בת-תיקון."
לצורך המחקר פיתחו החוקרים זן חדש של עכברים: זיווג של עכברים עם תסמונת ADNP עם עכברים בעלי חומר פלורסנטי זוהר במוחם, באמצעותם יכלו החוקרים לראות ולספור במדויק את כמות הסינפסות הנוצרות במוח. "החומר הזוהר מסמן את הנקודות במוח שבהן נוצרות הסינפסות – נקודות הקישור בין תאי העצב," מסבירה פרופ' גוזס. "מצאנו שבעכבר עם תסמונת ADNP נוצר רק כחצי ממספר הסינפסות בהשוואה לעכבר בריא – בעיקר באזורי הקורטקס וההיפוקמפוס של המוח, האחראים למרבית הפעילות הקוגניטיבית. אותם עכברים הראו תכונות של עיכוב התפתחותי, קושי חברתי ורגישות יתר, בדומה לילדים עם פיגור שכלי ואוטיזם."
בשלב הבא העניקו החוקרים טיפול לעכברים הפגועים: הזרקה יומיומית של הפפטיד NAP מרגע לידתם, והמשך טיפול כתרסיס לאף לעכברים שנגמלו מיניקת חלב האם. התוצאות היו מרשימות ביותר. העכברים המטופלים, בניגוד לאלה שלא טופלו, התפתחו באופן משופר ואף תקין על פי מגוון מדדים: הם השמיעו קולות כדי לקרוא לאימהותיהם, גילו יכולת הליכה וכושר זיכרון תקינים, ידעו להבחין בין עכבר מוכר לבלתי מוכר, ופיתחו כוח בשריריהם – בדומה לעכברים בריאים. בדיקת מוחם של העכברים שטופלו ב-NAP העלתה כי הוא החל לייצר מספר תקין של סינפסות.
המחקר בוצע על ידי קבוצת מחקר במעבדתה של פרופ' גוזס, בהשתתפות הדוקטורנטים גל הכהן-קליימן, שלמה סרגוביץ', גדעון כרמון ואיריס גריג, ובשיתוף עם חוקרים מאוניברסיטת מק'גיל בקנדה ומרכז BIOCEV לביוטכנולוגיה בצ'כיה. המאמר התפרסם לאחרונה בכתב העת Journal of Clinical Investigation.
נכון להיום נמצא NAP (המכונה גם 201CP) בפיתוח בחברת קורוניס נוירוסיינס, ופרופ' גוזס משמשת כמדענית הראשית של החברה. לאחרונה קיבלו אישור ממנהל המזון והתרופות האמריקאי למעמד של תרופת יתום לטיפול בילדים עם תסמונת ADNP. תרופות יתום מוגדרות כמוצר כימי או ביולוגי, המשמש לטיפול במחלה נדירה, אשר מספר החולים בה אינו עולה על 200,000 לפי המדד האמריקאי, או 190,000 באיחוד האירופי. תחת קטגוריה זו, גם תרופות למחלות מאוד נדירות, שפחות משתלם להשקיע בהן מבחינה כלכלית, זוכות לתקציבים ולמימוש. בתחילת ספטמבר נפגשו נציגי החברה עם נציגי ה-FDA והתוו דרך המשך ברורה להגשת התכנית הסופית לפיתוח התרופה חדשה.
"אנחנו מקווים ומאמינים שהמחקר שלנו יהווה קרש קפיצה לפיתוח טיפול מניעתי תומך בבני אדם," מסכמת פרופ' גוזס. "מניעה - ולו גם חלקית - של תופעות של אוטיזם ועיכוב התפתחותי, הנובעות מתסמונת ADNP, תמנע סבל רב מאלפי הורים וילדים בכל העולם."

מחקר
חוקרים מאוניברסיטת תל אביב בנו רובוט אוטונומי שמנווט באמצעות גלי קול – ממש כמו עטלף

רובוטים עצמאיים הם כבר מזמן לא תסריט מסרט מדע בדיוני. מכוניות ללא נהג, רחפנים זעירים וגם שואב אבק רובוטי, שמצחצח לנו את הבית בזמן שאנחנו עסוקים בדברים אחרים, כבר לא מפתיעים אף אחד. הרובוטים, שרק ילכו וישתכללו בשנים הקרובות, חולקים אתנו את אותו המרחב. גם הם, כמונו, צריכים לנווט ממקום למקום, לעקוף מכשולים ולהגיב לתנאי סביבה משתנים. האתגר של מפתחי רובוטים הוא למצוא דרכים "ללמד" אותם לעשות זאת בקלות.
חוקרים מאוניברסיטת תל אביב בנו רובוט ראשון מסוגו, שמסוגל לנווט ולהתמצא בסביבה שלו לא באמצעות חוש הראייה, כפי שפועלים רוב הרובוטים היום, אלא דווקא על בסיס חוש השמיעה. הרובוט החדש הוא הראשון בעולם המשתמש בסונאר, והפיתוח שלו מבוסס על מחקר מעמיק של יכולות הניווט של העטלפים. הרובוט, שזכה לכינוי Robat (שילוב של המילים robot ו–bat באנגלית), או בעברית "רובוטלף", הוא תוצאה של פרויקט פורץ דרך שתוצאותיו התפרסמו לאחרונה בכתב העת PLOS Computational Biology.
עטלפים משתמשים במנגנון הנקרא איכון הד כדי למפות סביבות חדשות. הם מפיקים גלי קול בתדרים גבוהים, ומעבדים את המידע המתקבל בגלים המוחזרים אליהם מהעצמים בסביבה. זהו מנגנון המתאים למי שלא מסתמך על חוש הראייה שלו. בצוללות, למשל, משתמשים בטכנולוגיה זו הנקראת סונאר לניווט ולגילוי ספינות. מודלים תיאורטיים רבים מנסים להסביר כיצד העטלפים עושים זאת, אך בפועל נעשו ניסיונות מועטים בלבד לבניית רובוט סונארי אוטונומי, אשר יחקה את פעילותם הייחודית ויתבסס אך ורק על חוש השמיעה.
תלמיד המחקר איתמר אליקים, בהדרכתם של ד"ר גבור קושה מבית הספר להנדסה מכנית, ופרופ' יוסי יובל מהמחלקה לזואולוגיה בפקולטה למדעי החיים ע"ש ג'ורג' ס' וייז ומבית הספר סגול למדעי המוח באוניברסיטת תל אביב, הצליח לבנות את הרובוט הראשון שמחקה את הביולוגיה הייחודית של העטלפים.
"למיטב ידיעתנו, זהו הרובוט האוטונומי הראשון בעולם שמשתמש בביולוגיה של עטלפים, כדי לנווט את דרכו ולמפות את הסביבה באמצעות איכון הד בלבד, והוא מהווה פריצת דרך בטכנולוגיית עולם הרובוטיקה", אומר פרופ' יובל.

הרובוטלף מנווט בשטח בעזרת חוש השמיעה בלבד (צילום: איתמר אליקים)
הרובוטלף, שבנייתו ארכה כשנתיים, מצויד ב"פה" עטלפי: רמקול על-קולי, המפיק צלילים בתדרים האופייניים לשידורי העטלף, ובזוג אפרכסות "אוזניים": שני מיקרופונים הקולטים תדרים על-קוליים. הוא מנווט את דרכו בשטח לא מוכר בזמן אמת אך ורק באמצעות צלילים, בעזרתם הוא מגדיר את גבולות העצמים במרחב, מסווג אותם באמצעות מחשב, וכך מייצר מפה מדויקת של סביבתו תוך הימנעות ממכשולים.
"היום רובוטים מנווטים בעיקר באמצעות חוש דמוי-ראייה, כלומר באמצעות מצלמות וקרני לייזר. זהו חוש נהדר, אך לא נטול חסרונות", מסביר פרופ' יובל ומרחיב, " ניווט בחושך, באבק או בעשן, כמו מתחת להריסות או במהלך שריפה, יהיה קשה לרובוט שפעילותו מתבססת על חוש הראייה. כך גם במקום בו יש קירות שקופים או סבך שיחים. הרובוטלף שלנו פשוט יעבור דרך השיח, מפני שהוא יכול לשמוע מבעד לעלים. לפיתוח הזה עשויות להיות השלכות גדולות בפיתוח רובוטים מרובי-חושים, כפי שאנו בני האדם מרובי-חושים".
הרובוטלף שופך אור גם על חייהם על העטלפים. "הפרויקט נעשה בהשראה ביולוגית, לכן העדפנו להיצמד למאפייני החיה האמתית, כפי שהיא מתקיימת בטבע. אם היינו רוצים לבנות את המכונה הטובה ביותר, היינו בונים אותה אחרת. למשל, עם יותר אוזניים", מספר פרופ' יובל. "כזואולוג אני חושב שתוך כדי תהליך למדנו עוד על העטלפים. למשל, למדנו להבין טוב יותר את סדר העדיפויות החישתי של העטלף, ואת האופן שבו הוא מפענח אותות בזמן אמת".
בימים אלה, אליקים ופרופ' יובל עובדים על שיפורים לרובוטלף. "במקביל לשיפור ולדיוק האלגוריתמים, התחלנו לעבוד על בניית מספר רובוטלפים שינווטו יחד כקבוצה, ממש כפי שחלק ממיני העטלפים פועלים בטבע", מגלה פרופ' יובל ומסכם "אמנם מדובר בתכנית לטווח הרחוק, אך אנחנו מאמינים כי בעתיד נשיק רובוטלף שגם יעוף כמו עטלף אמתי". באטמן, מאחוריך.

דבר לסונאר שלי. פרופ' יובל וזוג עטלפים